Состав и разновидности
Столкнувшись в результатах анализов кала с этим показателем, большинство родителей интересуется, что такое йодофильная флора. Это условно-патогенная микрофлора кишечника, состоящая из определенных видов микроорганизмов. Ее образование провоцируется наличием ферментов, которые способствуют переработке крахмала в соединения глюкозы. В результате деятельности бактерий сахар разделяется на отдельные элементы и возникает брожение, в котором активно участвуют кокки и дрожжевые клетки.
Йодофильная флора в кале у ребенка подразделяется на две группы:
- Клостридии, которые не представляют опасности для здоровья.
- Патологическая флора, в которой наблюдается наличие кокков и бацилл в большом объеме.
У грудничка они в норме должны отсутствовать, иногда анализ кала может выявлять их при запорах, но в малых количествах.
Клостридии в составе йодофильной флоры
Особенности образования йодофильных бактерий
Кишечную микрофлору представляют полезные и условно-патогенные микроорганизмы. В первом случае речь идет о лакто- и бифидобактериях, которые принимают участие в процессе пищеварения, синтезе органических веществ, укреплении кишечного иммунитета. Что касается условно-патогенной флоры, ее представляют кокки, палочки, дрожжеподобные клетки, которые, по-хорошему, усиливают перистальтику кишечника, перерабатывают белки. В идеале, полезные молочнокислые бактерии должны доминировать, условно-патогенные оставаться в меньшинстве и преобладать в стадии покоя.
При повышенной активности йодофильной флоры процессы брожения заметно усиливаются, в результате чего нарушается естественное переваривание пищи. Ребенка начинают беспокоить выраженные признаки диспепсии, расстройство пищеварения и не только. Чтобы восстановить баланс кишечной среды, необходим дополнительный прием пробиотиков, реализация других методов консервативной терапии.
Причины возникновения
Наличие патогенных бактерий в анализе кала может быть результатом изменения режима питания, увеличения объема потребляемых углеводов, например, крахмала. Если в рационе присутствует много фруктов, то нормальное прохождение пищи по пищеварительному тракту может быть нарушено, и есть риск возникновения гнилостных процессов. Это вовсе не означает, что, переходя с грудного вскармливания на обычное питание, необходимо проводить лечение или принимать какие-либо дополнительные меры. Если вводить новые продукты постепенно, то микрофлора самостоятельно справится с их правильным усвоением.
Также возникновение йодофильной флоры может быть спровоцировано рядом причин:
- сбои в работе желудка и тонкого кишечника;
- недостаточная выработка желудочного сока, желчи;
- заболевания поджелудочной железы;
- дисбактериоз;
- слишком быстрое перемещение пищи по системе пищеварения.
Такие вещества, как крахмал и глюкоза, способны повлиять на возникновение патогенных микроорганизмов в микрофлоре у детей. Их наличие создает прекрасную среду для размножения одноклеточных. Достаточно часто это явление носит временный характер, и после выведения углеводов из кишечника брожение завершается.
Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы
В
желудочно–кишечном тракте человека обитает множество бактерий, которые, по сути, являются симбионтами своего «хозяина». Как это ни парадоксально звучит, организм «хозяина» так же нуждается в микробных обитателях, как и они в его поддержке.
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
В кишечный биоценоз входит также небольшое количество условно патогенных организмов, образующих так называемую «остаточную популяцию»: стафилококки, грибы, протей, гемолитические штаммы (E.coli)
.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 105–108/г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 1010–1011 и более на 1 г содержимого.
В толстой кишке обитает основная масса анаэробных микроорганизмов. «Главную популяцию» (около 70%) составляют анаэробы – бифидобактерии и бактероиды. В качестве «сопутствующей популяции» выступают лактобациллы, кишечная палочка, энтерококки.
Бактерии, населяющие просвет желудочно–кишечного тракта, выполняют ряд функций, имеющих весьма важное значение для организма «хозяина».
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии
– синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli
вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Ограниченные первоначально представления о «местной» защитной роли кишечных микроорганизмов существенно расширились за последние годы. Микробиологами и иммунологами подчеркивается важность непрерывного «общения» оганизма «хозяина» со своими симбионтами. Путем контакта с микробной популяцией через слизистую оболочку и постоянного проникновения небольшого количества бактерий, их антигенов и продуктов метаболизма в кровоток поддерживается необходимая напряженность иммунитета, в том числе, вероятно, поддерживается «тонус» противоопухолевой защиты.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Механизмы поддержания нормального «микробного равновесия» в просвете желудочно–кишечного тракта и сдерживания микробного роста включают защитные факторы слизистой оболочки (бактерицидные свойства соляной кислоты желудка, выработка слизи и антител, главным образом, принадлежащих к классам иммуноглобулинов А и М), а также нормальную перистальтическую активность кишечника, в процессе которой часть бактерий регулярно удаляется во внешнюю среду. Целостность щеточной каёмки энтероцитов также выступает как важное звено защиты, поскольку выполняет роль «бактериального фильтра», препятствующего контакту бактерий с клетками слизистой оболочки.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике
(в англоязычной литературе –
bacterial overgrowth
) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Устаревший термин «дисбактериоз» использовать не совсем корректно, поскольку это название не в полной мере отражает сущность развивающихся нарушений.
С точки зрения микробиологии, избыточный бактериальный рост проявляется значительным уменьшением количества анаэробных представителей (особенно бифидобактерий), увеличением общего количества функционально неполноценных кишечных палочек («лактозо»–, «маннит»–, «индолоотрицательных»), содержанием гемолитических форм E.coli, созданием условий для размножения кандид.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
Нарушение пассажа внутрипросветного содержимого наблюдается при формировании межкишечных свищей, оперативных вмешательствах с формированием «слепых петель» кишечника, развитии дивертикулов, нарушении двигательной активности кишечника (запоры или поносы), кишечной непроходимости (обструктивной или паралитической). В этих условиях также создаются благоприятные условия для нарушения «бактериального равновесия».
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит
, который обусловлен избыточным размножением
Clostridium difficile
– облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция
C.difficile
в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность
C.difficile
(в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Синдром избыточного бактериального роста характеризуется различными клиническими проявлениями, «наслаивающимися» на проявления основного заболевания.
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Выраженные нарушения равновесия в составе кишечной микрофлоры могут сопровождаться признаками гиповитаминоза В12, В1, В2, В3 (РР). У пациента выявляются трещины в углах рта, глоссит, хейлит, поражения кожи (дерматит, нейродермит), железо– и В12–дефицитная анемия. Поскольку микрофлора кишечника служит важным источником викасола, могут наблюдаться нарушения свертывания крови. В ряде случаев в результате нарушения обмена желчных кислот развиваются симптомы гипокальциемии (онемение губ, пальцев, остеопороз). Ряд авторов связывает нарушения обмена холестерина с нарушением «микробного баланса» желудочно–кишечного тракта.
Диагностика синдрома избыточного бактериального роста
подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания
позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Устаревший подход «санировать – и вновь заселить кишечник» не соответствует современным представлениям о патогенезе избыточного бактериального роста.
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия
(назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков
.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
«Колибактерин» содержит взвесь живых бактерий штамма E.coli
M–17, обладающего антагонизмом по отношению к условно–патогенной и патогенной микрофлоре. Назначают по 6–10 доз в 1–2 приема за 40 мин до еды в течение 3–4 недель.
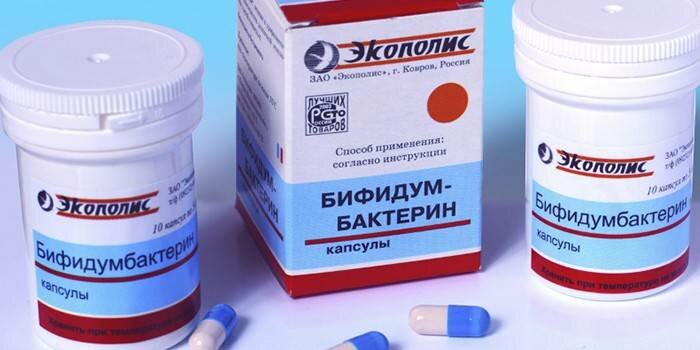
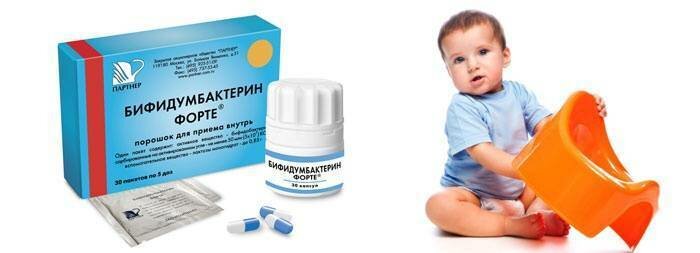
«Бифидумбактерин» содержит штамм бифидобактерий, устойчивых к антибиотикам. Назначают по 5–10 доз в сутки в 1–2 приема в течение 2–3 недель. «Бифидумбактерин» наиболее благоприятно действует при наличии у пациента запоров.
«Бификол» – сочетание совместно выращенных культур E.coli
M–17 и бифидумбактерий. В сутки назначают 6–10 доз.
«Лактобактерин» приготовлен из молочнокислых бактерий. Микробы, входящие в состав этого препарата характеризуются высокой устойчивостью к антибиотикам. Лактобактерии эффетивно угнетают рост протея, гемолитических штаммов стафилококка и поддерживают рост популяции E.coli
. Применяют по 3–6 доз в сутки. Лечебной и профилактической активностью обладают также молочные продукты, содержащие культуру молочнокислых бактерий, аналогичную входящей в состав «Лактобактерина» – ацидофильный дрожжевой творог и ацидофильное молоко, а также биомасса ацидофильных лактобактерий, носящая название «Наринэ».
В настоящее время широко применяется препарат «Энтерол», содержащий в составе лиофилизированные лечебные дрожжи Saccharomyces boulardii
, обладающие природной устойчивостью к антибиотикам.
S. boulardii
не колонизируют пищеварительный тракт и элиминируются с калом в течение нескольких дней после завершения курса терапии. Они вырабатывают белки, препятствующие связыванию патогенных микроорганизмов и их токсинов со слизистой оболочкой кишечника; стимулируют защитные свойства слизистой оболочки.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Существует и другой, совершенно оригинальный, подход к нормализации среды в просвете кишечника, что способствует восстановлению нормальной популяции его «обитателей». Данное направление фармакологической коррекции избыточного бактериального роста представлено препаратом «Хилак–форте»
.
Препарат «Хилак–форте» представляет собой стерильный концентрат биологически активных веществ, вырабатываемых нормальной микрофлорой кишечника (как грамположительной, так и грамотрицательной). Среди них – молочная кислота и короткоцепочечные летучие жирные кислоты (обладающие антибактериальными свойствами в отношении условно–патогенной и патогенной флоры), молочно–солевой буфер, лактоза, аминокислоты. Всего в одной капле концентрата содержатся продукты биосинтеза 100 миллиардов кишечных бактерий.
«Хилак–форте» позволяет создать благоприятные условия для размножения молочно–кислых бактерий
(за счет снижения рН, восстановления водно–электролитного баланса в просвете кишечника и подавления конкурентной флоры). Интересно, что действие препарата не ограничивается влиянием на бактериальный состав, о также стимулирует регенерацию эпителия слизистой оболочки кишечника.
«Хилак–форте» показан при самых разнообразных состояниях, сопровождающихся нарушением «микробного баланса»: нарушениях мальдигестии и мальабсорбции различного происхождения, нарушении перистальтической активности кишечника, в периоде выздоровления после острых инфекционных энетроколитов и т.д. Назначение «Хилак–форте» целесообразно во время лечения антибиотиками и некоторое время после их отмены для профилактики нарушений в составе кишечной микрофлоры.
«Хилак–форте» характеризуется высокой эффективностью и хорошей переносимостью. Противопоказаний к назначению препарата и побочных действий не выявлено. его можно назначать не только взрослым, но и детям грудного возраста.
«Хилак–форте» принимают внутрь до или во время еды, разбавив небольшим количеством жидкости (не щелочной реакции!).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
«Хилак–форте» нельзя принимать в одно время суток с антацидными препаратами и адсорбентами, поскольку антациды нейтрализуют, а адсорбенты – снижают биодоступность кислот, входящих в состав препарата.
Диагностируя у пациента синдром избыточного бактериального роста, необходимо понимать главное в коррекции этого состояния – не агрессивно вмешиваться в микробный биценоз, а «протянуть руку помощи» микробам, обеспечивающим наше здоровье и благополучие.
Литература:
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
4. Ивашкин В.Т., Комаров Ф.И., Рапопорт С.И., ред. Краткое руководство по гастроэнтерологии. – М.: Издательский дом «М–Вести», 2001 г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
6. Fauci A.S., Braunwald E., Isselbacher K.J. et al., ed. Harrison’s Principles of Internal Medicine. 14th edition – Copyright (c) 1998 by The McGraw–Hill Companies, Inc., USA.
7. Herfindal Е.Т., Gourley D.R., ed. Textbook for therapeutics: drug and disease managment – 6th ed. – Copyright (c) 1996 Williams & Wilkins, Baltimore, USA.
Проявление йодофильной флоры в различном возрасте
В идеальном анализе число патогенных одноклеточных должно быть равно нулю, но и несколько отличающиеся результаты также считаются нормой для ребенка и в большинстве случаев никак не проявляются.
В возрасте до 1 года йодофильная микрофлора обычно проявляется при снижении уровня полезных бифидо- и лактобактерий в кишечнике. Вместо них начинают размножаться кокки и дрожжевые микроорганизмы. В большинстве случаев этот процесс не имеет ярко выраженной симптоматики, он не влияет на сон, аппетит и настроение ребенка.
У детей от 1 до 3 лет также не должно наблюдаться побочных микроорганизмов в составе микрофлоры. Нормальным показателем является присутствие не более 8 г бактерий в сутки. У детей старше 1 года уже практически сформирована пищеварительная система, поэтому признаков нарушения состава микрофлоры также может не быть.
В патогенной микрофлоре нередко присутствуют кокки
Копрология: исследование и расшифровка
Патологическая флора не влияет на общее самочувствие. Поэтому выявить ее саму по себе, просто наблюдая за детьми, невозможно. У малышей отсутствуют видимые изменения стула, нет болевого синдрома, аппетит остается на прежнем уровне.
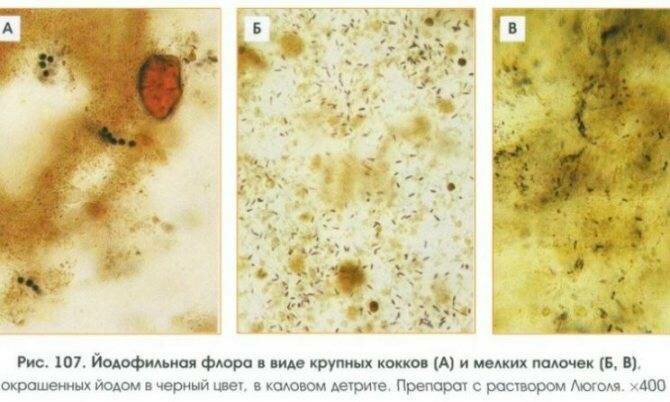
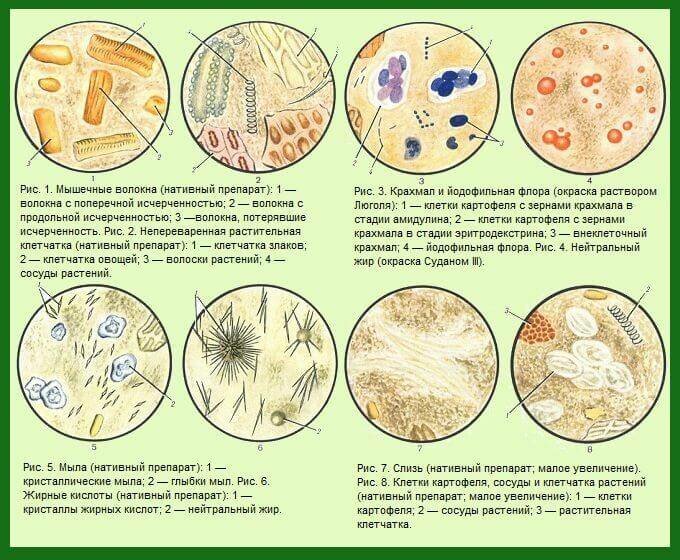
Для этого испражнения обрабатывают раствором йода (отсюда и пошло название) и реакцию наблюдают в микроскоп. При взаимодействии с раствором йода бактерии окрашиваются в насыщенный темный цвет синего или фиолетового оттенка. Так, например, клостридии пигментируются только в средине, а остальные (дрожжи и кокки) окрашиваются полностью.
При выявлении йодофильных бактерий в расшифровке анализа кала обязательно будут описаны, какие именно и в каком количестве бактерии присутствуют.
Во многом копрограмма является очень информативным медицинским исследованием, которое может обнаружить не только патогенные бактерии, но и слизь, нейтральный жир, скрытую кровь, и в целом рассказать о функционировании желудочно-кишечного тракта.
Лечение повышенной йодофильной флоры в кале
Один из факторов размножения патогенных одноклеточных – дисбактериоз – наблюдается чаще всего. Исходя из этого, лечение детей производится следующими способами:
- В том случае, если ребенок находится на ГВ (грудном вскармливании), то необходимо скорректировать режим питания матери, исключив из рациона продукты, богатые клетчаткой, крахмалом и сложными углеводами.
- При искусственном вскармливании нужно поменять используемую смесь.
- Применение лекарственных препаратов, блокирующих размножение микроорганизмов.
- Прием пробиотиков, способствующих нормализации микрофлоры кишечника у ребенка.
В тех случаях, когда присутствие йодофильной флоры в анализе кала вызвано более серьезными заболеваниями, врач должен назначить специальную программу лечения, направленную именно на первопричину болезни.
При выявлении вредоносных бактерий в кишечнике необходимо бороться с ними. Если не принять необходимых мер, то наличие патогенных микроорганизмов может спровоцировать развитие серьезных нарушений в работе органов пищеварения.
Анна
Как правильно лечить недуг?
Вначале нужно выяснить причину его появления, а потом приступать к лечению. Чаще всего активизация процесса брожения связана с дисбактериозом.
Тогда количество полезных микроорганизмов резко уменьшается, а патогенных – увеличивается. Чтобы восстановить нормальную микрофлору
кишечника, нужно:
- Когда ребенок еще грудного возраста, его кормят грудным молоком, достаточно убрать из меню мамы блюда с содержанием растительной клетчатки, сложных углеводных соединений, крахмала.
- Если вскармливание искусственное, рекомендуется перевести малыша на другое детское питание.
- Детям постарше назначают медикаменты, имеющие способность поглощать и нейтрализовать патогенные микроорганизмы. Их называют бактериофагами.
- Иногда выписываются пробиотики с содержанием живых лактобактерий
, относящихся к полезной группе микроорганизмов. - Когда ребенок уже питается самостоятельно, для восстановления нормальной микрофлоры в его кишечнике в меню вводятся ограничения. Почти исключаются фрукты, овощи, сахар. Нельзя есть продукты, в состав которых входит крахмал. Особенно это касается картофеля.
В крайних случаях необходимо ультразвуковое исследование и дополнительные анализы, чтобы поставить точный диагноз и определить, какое лечение необходимо.
Клиническая картина
Обнаружение йодофильной флоры на фоне полного благополучия не должно пугать родителей. Скорее всего, накануне малыш съел много сладостей или других нежелательных продуктов. Чтобы убедиться в отсутствии проблем, нужно сдать повторную копрограмму через 7–10 дней.
Иногда дисбактериоз является первым признаком серьезных болезней. В таком случае патологическая флора будет определяться в анализе регулярно.
К явным признакам заселения кишечника йодофильной флорой относятся:
- боль и урчание в животе;
- диарея или понос;
- изменение цвета и запаха кала;
- повышенное газообразование;
- тошнота, иногда рвота;
- кожные высыпания.
При постоянном дисбактериозе дети плохо набирают вес, часто болеют, становятся слабыми и вялыми. Это прежде всего связано с нарушением всасывания питательных веществ на фоне гибели полезной микрофлоры и воспалением стенок кишечника.
В зависимости от причины дисбактериоза, кожа ребенка может приобретать зеленоватый или желтый оттенок.
Описание флоры этого типа
Йодофильные бактерии в человеческом организме провоцируют возникновение бродильного процесса в отделах кишечника. Перерабатывание крахмала в глюкозу осуществляется за счет активных веществ. Под взаимодействием микроорганизмов происходит ее распад на составляющие органического типа.
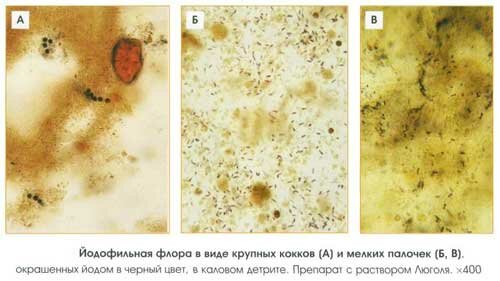
Брожению же способствуют кокки и дрожжи, скапливающиеся внутри клеток. Все микроорганизмы, задействованные в процессе, подразделяют на 2 главные категории:
- патологические – кокки и палочки, присутствующие в огромных количествах;
- клостридии – грамположительные бактерии, которые есть в нормальной флоре ЖКТ и половых органах женщин.
Местом локализации болезнетворных микроорганизмов становится слепой отдел кишечника. На фоне их повышенного роста происходит вырабатывание химуса, в результате чего кислотная реакция ускоряется. Под воздействием такого процесса и осуществляется брожение.