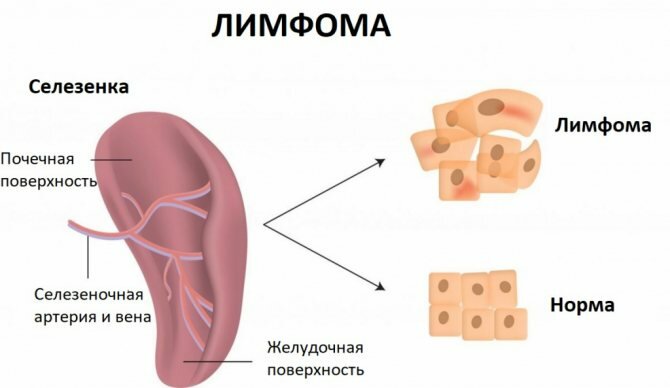
Злокачественные опухоли селезенки встречаются очень редко. Они могут быть первичными (когда новообразование изначально развивается в селезенке) и метастатическими (когда в селезенку распространяются опухолевые клетки из других органов).
- Причины развития и группы риска
- Классификация, стадии
- Симптомы рака селезенки
- Метастазы при раке селезенки
- Методы диагностики
- Лечение рака селезенки
- Осложнения
- Рецидив онкологического заболевания
- Прогноз выживаемости
- Профилактика
Причины развития и группы риска
Злокачественные опухоли развиваются в результате мутаций, которые возникают в клетках. Эти мутации затрагивают гены, регулирующие клеточное размножение, апоптоз (запрограммированную клеточную гибель), восстановление поврежденной ДНК. Почему такие мутации произошли в каждом конкретном случае — сказать сложно.
Некоторые условия повышают вероятность развития рака — их называют факторами риска. Если говорить о самой распространенной разновидности рака селезенки — лимфоме, то факторы риска будут следующими:
- Возраст. С годами в клетках тела человека накапливаются мутации и повышается вероятность развития различных типов рака.
- Пол. Мужчины болеют чаще.
- Семейный анамнез: если лимфома была диагностирована у близких родственников.
- Нарушения со стороны иммунной системы: ослабленный иммунитет, аутоиммунные заболевания.
- Воздействие на организм некоторых вредных веществ.
- В ходе некоторых исследований была обнаружена связь между хроническим гепатитом C и B-клеточной неходжкинской лимфомой.

Классификация, стадии
«Рак селезенки» — не совсем правильный термин. Строго говоря, раком называют такие опухоли, которые происходят из эпителиальной ткани. В селезенке же злокачественные новообразования развиваются из других типов тканей. Классификации их менялись со временем и различаются у разных авторов. В настоящее время врачи часто руководствуются классификацией L. Morgenstern, разработанной в 1985 году. В соответствии с ней, все злокачественные опухоли органа делят на три большие группы: сосудистые, лимфоидные и нелимфоидные:
| Примеры сосудистых опухолей |
|
| Примеры лимфоидных опухолей |
|
| Примеры нелимфоидных опухолей |
|
Чаще всего в селезенке встречаются лимфомы. При этом первичное поражение органа — редкое явление. Известно, что при неходжкинской лимфоме селезенка вовлекается в 50–80% случаев, часто это происходит и при болезни Ходжкина.
Из сосудистых злокачественных опухолей в селезенке чаще всего встречается ангиосаркома. Тем не менее, это очень редкое заболевание — его выявляют у 1–3 людей из десяти миллионов. Ангиосаркома происходит из тканей сосудистой стенки, отличается высокой агрессивностью, быстро дает метастазы.
Запись на консультацию круглосуточно
+7+7+78
Симптомы рака селезенки
Диагностировать рак селезенки по симптомам очень сложно. Проявления заболевания неспецифичны, они могут встречаться при многих патологиях, в том числе при других типах рака. При лимфомах у 25% больных вообще нет жалоб, и опухоль диагностируется случайно.
Основные симптомы:
- боль в животе, обычно в его верхней части слева;
- слабость, повышенная утомляемость;
- потеря веса без видимой причины;
- повышение температуры тела;
- потливость по ночам;
- увеличение подкожных лимфоузлов: в подмышечной и паховой областях, на шее;
- повышенная кровоточивость, которая проявляется в виде синяков на коже;
- снижение аппетита;
- частые инфекции.
Важно обращать внимание на любые необычные симптомы. Если они сохраняются в течение нескольких дней, нужно обратиться к врачу. Это помогает своевременно диагностировать рак и другие заболевания.
Исследование кровеносных сосудов брюшной полости
В нашей лечебной практике для исследования сосудов брюшной полости чаще всего используются такие методы диагностики:
- УЗИ сосудов
- МРТ сосудов (МР-ангиография)
- КТ сосудов (КТ-ангиография)
- Классическая рентгенография сосудов
УЗИ сосудов брюшной полости позволяет увидеть сосуды «изнутри», в режиме реального времени. Это доступно благодаря свойству эритроцитов отражать ультразвуковые волны. Такое свойство называется эффектом Допплера, от которого пошло название самого метода исследования – ультразвуковая допплерография сосудов. УЗДГ или ультразвуковая допплерография сосудов дает возможность выявить любое изменение кровотока в сосудах брюшной полости, которое может быть связанно со спазмом стенок сосудов, сужением их просвета или тромбозом.
На УЗИ видны крупные сосуды: брюшная аорта, ее основные ветви, нижняя полая вена. Мы измерим диаметр сосудов, оценим их просвет, выявим, если они есть, тромбы и/или атеросклеротические бляшки. В случае тромбоза мы можем определить его размеры и отслеживать изменения в его структуре во время лечения.
УЗИ поджелудочной железы.
МР и КТ (МСКТ)-ангиография. Главное преимущество КТ и МРТ сосудов – это возможность исследовать сосуды с контрастом и создание их 3D модели для более подробной диагностики. Таким образом, можно осмотреть брюшную аорту и её ветви, идущие к почкам, печени, селезенке, кишечнику и т.д., на предмет расслоения стенки и аневризмы аорты, тромбоза, сдавления сосуда опухолью, сужения просвета сосуда (сужение почечных артерий – одна из возможных причин гипертонии). Кроме артерий мы можем оценить состояние сосудов на предмет тромбозов (простых и воспалительных т.е. связанных с сепсисом) и т.п.
Классическая рентгеновская ангиография (рентгенография сосудов с контрастом). На данный момент рентген сосудов используется реже ввиду его большей технической сложности по сравнению с КТ или МРТ сосудов.
Методы диагностики
При злокачественных новообразованиях часто отмечается увеличение селезенки. Его можно обнаружить во время ультразвукового исследования, компьютерной, магнитно-резонансной томографии. Однако, если селезенка увеличена, это еще не говорит о том, что у человека рак. Это может быть доброкачественное новообразование.
Если обнаружено увеличение селезенки, врач может назначить развернутый анализ крови, исследование красного костного мозга. Самый точный метод диагностики злокачественной опухоли — биопсия. Материал для гистологического и цитологического анализа можно получить путем пункции (с помощью полой иглы), либо удалив селезенку.
Можно ли диагностировать рак селезенки на ранних стадиях, до появления первых симптомов? Специальных скрининговых тестов не существует. Нет таких исследований, которые можно было бы рекомендовать регулярно проходить всем людям. Повышенное внимание к своему здоровью нужно проявлять лицам, у которых есть некоторые факторы риска: вирусные гепатиты B и C, иммунодефицитные состояния, аутоиммунные патологии, лечение иммуносупрессорами. Если стали беспокоить симптомы, которые перечислены в этой статье — нужно посетить врача и провериться.
Процедура
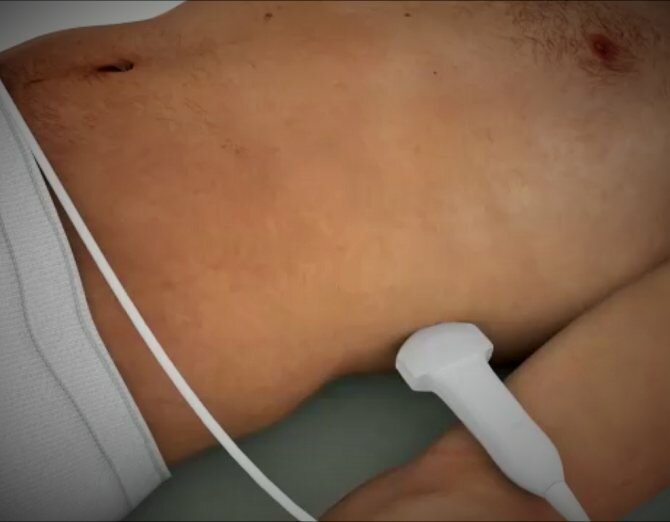
Само обследование осуществляется следующим образом. Человек оголяет живот и укладывается на кушетку в положении лежа на спине. Врач наносит специальный гель на область исследования и на датчик для улучшения скольжения. Сперва сканирование проходит посередине линии живота, а затем смещается влево на 10 см. Таким образом врач постепенно меняет направление и последовательно водит датчиком по области сканирования. На экране аппарата появляются подробные изображения селезенки и соседних тканей. Если у больного аномалия развития селезенки, могут возникнуть сложности в проведении ультразвукового сканирования. В таком случае доктор меняет положение пациента. Решением проблемы будет позиция лежа на правом боку. Левую руку пациент поднимает за голову, глубоко вдыхает, и на задержке дыхания врач сканирует селезенку через межреберное пространство.
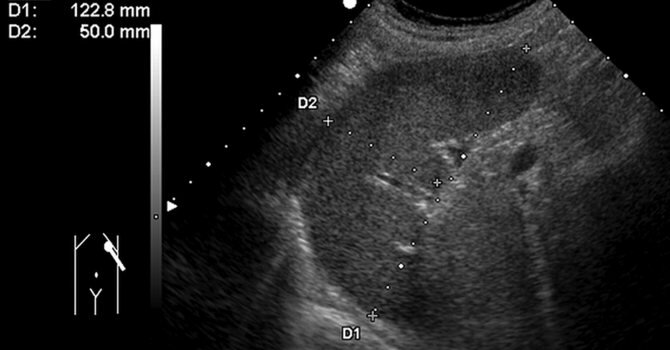
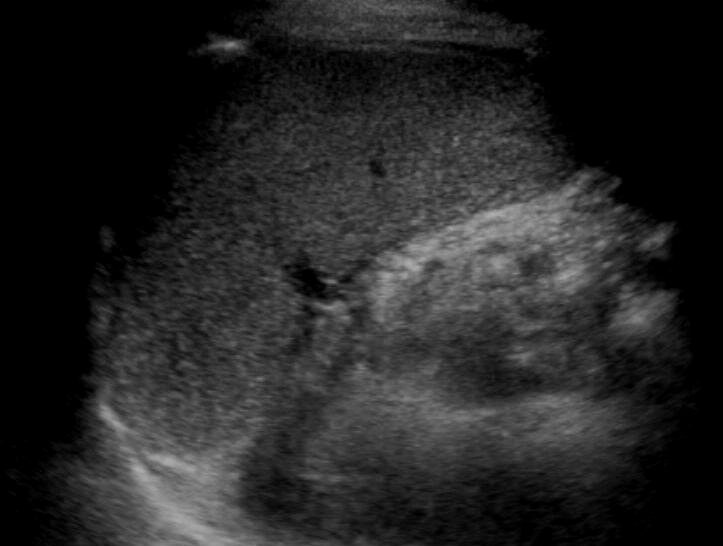
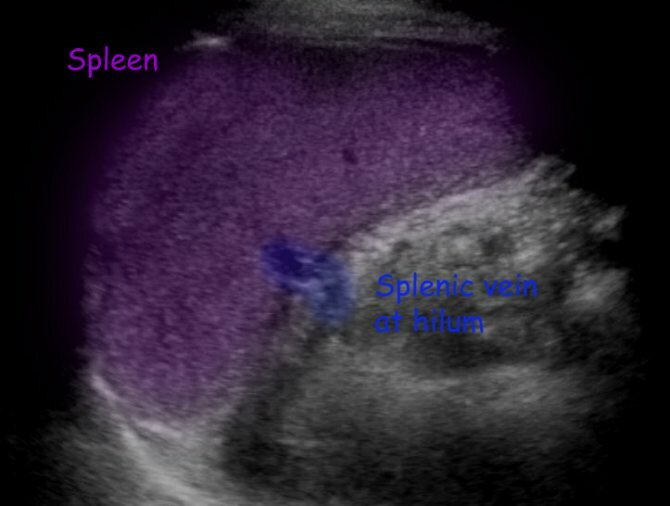
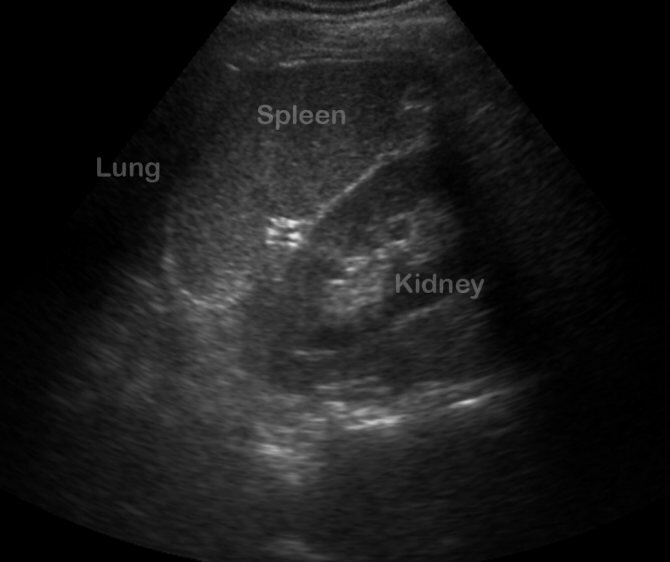
Как выглядит селезенка на УЗИ?
Лечение рака селезенки
Подходы к лечению зависят от типа и стадии злокачественной опухоли. Например, при лимфомах, если нет симптомов, достаточно раз в полгода являться на осмотры к врачу и сдавать анализы крови. Если же, например, в селезенке обнаружен метастаз солидной опухоли, требуется активное лечение. Ниже мы рассмотрим основные принципы лечения лимфом как наиболее часто встречающихся опухолей селезенки.
Хирургические вмешательства
Основной вид лечения лимфомы селезенки — удаление органа, спленэктомия. Как показывает статистика, большинству пациентов, перенесших такое хирургическое вмешательство, в течение последующих пяти лет не требуется каких-либо других видов лечения.
Химиотерапия
В некоторых случаях используют химиопрепараты — лекарственные средства, которые уничтожают опухолевые клетки. Некоторые из них вводят внутривенно, другие принимают в виде таблеток. Тип, дозировки и график введения химиопрепаратов подбирают в зависимости от типа и стадии опухоли.

Исследования показали, что эффективной альтернативой спленэктомии при лимфомах может стать ритуксимаб — препарат из группы моноклональных антител. Он помогает избавиться от симптомов и избежать сложного хирургического вмешательства.
Лучевая терапия
В некоторых случаях для борьбы с лимфомами применяют лучевую терапию. Используют рентгеновское излучение, протонную терапию.
Лучевая терапия применяется как самостоятельный вид лечения для борьбы с опухолью на ранних стадиях. На поздних стадиях и при агрессивных новообразованиях ее сочетают с химиотерапией. Кроме того, облучение помогает бороться с симптомами, вызванными метастазами.
Пересадка стволовых клеток
Пересадка стволовых клеток (трансплантация красного костного мозга) показана в случаях, когда опухоль не поддается лечению химиопрепаратами и лучевой терапией. Назначают высокие дозы химиопрепаратов или облучения, чтобы подавить собственный красный костный мозг, затем в кровь пациента вводят стволовые клетки красного костного мозга — собственные или донорские.
В XXI веке травма приобрела характер пандемии. В систематическом обзоре литературы [63] приведены данные о том, что ежегодно от травмы погибают 5,8 млн человек, а к 2021 г. эта цифра может вырасти до 8,4 млн. Дорожно-транспортные происшествия являются самой частой причиной смерти людей в возрасте от 15 до 44 лет.
Среди закрытых повреждений органов брюшной полости травма селезенки, по данным разных авторов, составляет от 16 до 50%, занимая по частоте 1-2-е место [11, 14, 27, 57, 77].
Хирургия повреждений селезенки прошла несколько этапов. Спленэктомию выполняли в Китае во втором веке нашей эры [64], однако впервые она была описана в медицинской литературе в 1549 г. [43]. В 1581 г. Viard удалил часть селезенки, выпавшую через колото-резаную рану брюшной стенки [24]. В обоих случаях наступило выздоровление. До 80-х годов прошлого века спленэктомия была единственной операцией при травме селезенки. Так, в руководстве по оперативной хирургии написано: «В связи с этим обстоятельством, характеризующим паренхиматозный орган, кроме спленэктомии, то есть полного удаления селезенки, никакие иные вмешательства на ней не рекомендуются» [15]. Углубление знаний о многочисленных функциях селезенки [18], в том числе иммунной [7, 16, 17], привело к разработке органосохраняющих операций [2, 8, 10] и аутотрансплантации ткани селезенки [1, 19]. После успешного применения консервативной терапии повреждений паренхиматозных органов у детей эта тактика была распространена на взрослых [68].
Морфологические аспекты травмы селезенки, в том числе двухмоментного разрыва, исследованы в работах А.П. Вилька и соавт., М.А. Сапожниковой и I. Riezzo и соавт. [9, 20, 69].
Для повреждения селезенки, особенно патологически измененной, не требуется приложения большой силы. Хорошо известны случаи ее спонтанного разрыва при различных заболеваниях [25, 42, 46, 51, 74, 87]. Прочность селезенки на разрыв на 4/5 обеспечивается неповрежденной капсулой [73].
В настоящее время общепринятой является классификация повреждений (Organ Injury Scaling), The American Association for the Surgery of Trauma [58]. Раздел, посвященный повреждениям селезенки, опубликован в 1989 г. и пересмотрен в 1994 г. (см. таблицу

).
Повреждение селезенки можно предполагать, исходя из механизма травмы (удар в левую половину туловища), при наличии переломов VIII-XII ребер слева. K. Boris и соавт. [30] показали, что вероятность повреждения селезенки у пострадавших с переломом пяти и более ребер с левой стороны превышает таковую у пострадавших с переломом от одного до четырех ребер, однако тяжесть повреждения селезенки не коррелирует с количеством сломанных ребер. Клиническая картина разрыва селезенки характеризуется признаками внутрибрюшного кровотечения. Патогномоничным для травмы селезенки считают симптомы Kehr (френикус-симптом, т.е. боль в области левого надплечья и левого плечевого сустава) и ваньки-встаньки (усиление боли в горизонтальном положении больного), хотя они встречаются очень редко [3]. Следует помнить, что у пострадавшего с нарушением сознания и при сочетанной травме с доминирующими повреждениями в других областях тела клиническая картина может быть завуалирована [79]. Следовательно, любому пострадавшему с травмой живота показано инструментальное обследование и клиническое наблюдение.
Возможности и ограничения различных диагностических методов (УЗИ, КТ, лапароцентез и лапароскопия) были обсуждены в предыдущей лекции. По данным анкетирования, более 80% швейцарских хирургов начинают инструментальное обследование при абдоминальной травме с УЗИ [72], и автор лекции поддерживает эту точку зрения. Поскольку методика FAST имеет низкую чувствительность в определении травмы селезенки [35], у гемодинамически стабильных пострадавших при УЗИ необходимо осматривать органы брюшной полости и забрюшинного пространства. Подозрение на травму органов брюшной полости на основании данных УЗИ (в том числе жидкость в брюшной полости и забрюшинное кровоизлияние) является показанием к проведению КТ.
КТ — наиболее точный диагностический способ, позволяющий установить тяжесть повреждения селезенки и обнаружить признаки продолжающегося кровотечения [70]. Использование КТ при травме, по данным F. Swaid и соавт. [77], способствовало существенному уменьшению количества диагностических лапаротомий. Обязательным является внутривенное контрастное усиление и сканирование в артериальную, портальную венозную и отсроченную фазы [31]. В артериальную фазу лучше выявляются повреждения артерий [80], в венозную и отсроченную — продолжающееся кровотечение и разрыв паренхимы. Ложная артериальная аневризма, наличие зоны повышенного накопления контрастного вещества в паренхиме (blush), большое количество жидкости в брюшной полости служат признаками продолжающегося кровотечения [32]. Учитывая риск повторного кровотечения у пострадавших, которых лечат консервативно, многие исследователи рекомендуют выполнять повторную КТ в сроки от 48 часов [55] до 7 сут [60] после травмы.
Лапароцентез и диагностический перитонеальный лаваж в последние годы применяют реже, чем неинвазивные методы диагностики. Показанием к применению лапароцентеза и перитонеального лаважа является неинформативность УЗИ и невозможность выполнить КТ. Считаем необходимым напомнить, что лапароцентез и лапароскопия не позволяют диагностировать центральную гематому селезенки и, следовательно, проводить адекватную этому состоянию терапию. В таких ситуациях интенсивное внутрибрюшное кровотечение при двухмоментном разрыве селезенки оказывается полной неожиданностью как для пострадавшего, так и для хирурга.
Все исследователи считают основным фактором, влияющим на выбор тактики при травме селезенки, показатели гемодинамики [48, 49, 53, 86, 89].
Пострадавшие с нестабильной гемодинамикой и большим количеством жидкости в брюшной полости, по данным УЗИ или положительным результатом лапароцентеза, требуют немедленной лапаротомии [75].
Операция при интенсивном внутрибрюшном кровотечении направлена на спасение жизни, поэтому должна выполняться настолько быстро, насколько это возможно. Автор лекции, имеющий 25-летний опыт экстренной хирургии, в основном хирургии повреждений, считает необходимым напомнить неукоснительную последовательность действий во время лапаротомии у пострадавшего с абдоминальной травмой. Как уже было сказано в предыдущей лекции, универсальным доступом при абдоминальной травме является верхняя средне-срединная лапаротомия.
Лапаротомия, снимая тампонирующий эффект, может приводить к гипотонии. Если снижение давления имеет выраженный или критический характер, а ревизия органов брюшной полости затруднена или невозможна вследствие большого гемоперитонеума, целесообразно прижать кулаком аорту к позвоночнику сразу ниже диафрагмы. Этот прием позволяет добиться некоторой стабилизации гемодинамики, дает дополнительное время на инфузионную терапию и аспирацию крови, которую целесообразно выполнять с использованием аппаратов для реинфузии.
После эвакуации крови из брюшной полости выполняют ее полноценную и быструю ревизию. При необходимости опорожнить желудок устанавливают назогастральный зонд. Тонкую кишку эвентрируют из брюшной полости, а поперечную ободочную оттягивают каудально — это улучшает обзор верхнего отдела брюшной полости. Осматривают и пальпируют органы брюшной полости в следующем порядке: диафрагмальная поверхность правой доли печени и правая половина диафрагмы; висцеральная поверхность правой доли печени и желчный пузырь; диафрагмальная и висцеральная поверхности левой доли печени; левое поддиафрагмальное пространство (селезенка и левая половина диафрагмы). Каждый этап осмотра заканчивают тампонадой правого поддиафрагмального, подпеченочного и левого поддиафрагмального пространств. Затем осматривают абдоминальный отдел пищевода, переднюю стенку желудка с малым сальником, видимую через брюшину часть двенадцатиперстной кишки. После этого проводят ревизию ободочной кишки в направлении от слепой к сигмовидной с одновременным осмотром брюшины латеральных каналов и пальпацией почек. Переместив поперечную ободочную кишку каудально, последовательно, от связки Трейтца до илеоцекального перехода, осматривают тонкую кишку, ее брыжейку и оба брыжеечных синуса. На поврежденные артерии накладывают зажимы Бильрота или сосудистые — в зависимости от необходимости реконструктивной сосудистой операции, сквозные разрывы органов желудочно-кишечного тракта изолируют салфетками, смоченными антисептиком.
После окончания ревизии брюшной полости тампоны удаляют. Промокание тампона кровью свидетельствует о продолжающемся кровотечении и указывает на его возможный источник. Следует подчеркнуть, что полноценная ревизия органов брюшной полости предшествует восстановительному этапу операции. Типичная ошибка молодых хирургов заключается в том, что сначала ушивают то повреждение, которое первым бросилось в глаза, затем продолжают ревизию и снова прерывают ее для репарации другого обнаруженного повреждения и т.д. При такой неправильной последовательности действий травма аорты или нижней полой вены будет обнаружена последней со всеми вытекающими последствиями. О показаниях к ревизии забрюшинного пространства и методах ее выполнения будет рассказано в одной из следующих лекций.
Итак, травма селезенки обнаружена. Что делать? Ключом к любой операции на селезенке являются ее мобилизация и выведение на уровень лапаротомной раны. В отличие от больных с гематологическими заболеваниями, это удается сделать у большинства пострадавших. Попытки выполнить операцию на селезенке в глубине левого поддиафрагмального пространства чреваты дополнительной кровопотерей, плохим гемостазом и травмой хвоста поджелудочной железы. Предложены два способа мобилизации селезенки, условно их можно назвать «передний» и «задний».
При первом способе в бессосудистой зоне рассекают желудочно-селезеночную связку, затем разрез связки расширяют с обязательным гемостазом из коротких желудочных артерий и вен, обеспечивая достаточный доступ в сальниковую сумку. Полного рассечения желудочно-селезеночной связки на этом этапе операции не требуется. После визуализации селезеночной артерии по верхнему краю поджелудочной железы париетальную брюшину над ней рассекают на небольшом протяжении. Артерию аккуратно «обходят» со всех сторон (для этого наиболее удобен длинный диссектор с короткими острыми кончиками, изогнутыми под прямым углом), после чего под нее подводят нерассасывающуюся лигатуру условным размером USP 0 или 1. После завязывания лигатуры существенно уменьшаются приток крови к селезенке и ее размеры, снижается кровопотеря. Вторым этапом заканчивают разделение желудочно-селезеночной связки, в каудальном направлении перевязывая и пересекая ветви левой желудочно-сальниковой артерии и вены, а в краниальном — короткие желудочные сосуды. Расстояние между желудком и селезенкой минимально в области верхнего полюса селезенки, наложенные здесь лигатуры могут соскользнуть при послеоперационном расширении желудка, поэтому перевязку коротких желудочных сосудов в этом месте лучше выполнить с прошиванием серозной и мышечной оболочек стенки желудка 8-образными швами. Затем хирург левой рукой охватывает селезенку с диафрагмальной стороны и смещает ее в сторону лапаротомной раны. Этот прием позволяет натянуть селезеночно-почечную связку, которая не содержит сосудов. Селезеночно-почечную связку пересекают ножницами и выводят селезенку в лапаротомную рану. Следующим этапом между зажимами пересекают и перевязывают селезеночно-ободочную связку. Автор обращает внимание читателей на тот факт, что в используемой сейчас международной анатомической номенклатуре у селезенки имеются только две связки — желудочно-селезеночная и селезеночно-почечная, которую ранее называли диафрагмально-селезеночной [13]. Хирурги выделяют еще селезеночно-ободочную и поджелудочно-селезеночную связки [15, 90]. Авторы известного учебника анатомии [21] называют желудочно-селезеночную и селезеночно-почечную связки большими, а остальные малыми.
«Задний» способ применяют при мобильной селезенке, его легче выполнить у худощавых пациентов и при наличии широкого реберного угла. Мобилизацию начинают со смещения селезенки в сторону лапаротомной раны и пересечения селезеночно-почечной связки. Проникнув указательным пальцем правой руки, а затем и кистью в жировую клетчатку, хирург расслаивает ее, мобилизуя этим селезенку с хвостом поджелудочной железы [5]. Следует подчеркнуть, что во время этого маневра необходимо тыльной поверхностью пальца или кисти ощущать переднюю поверхность почки, это свидетельствует о нахождении «в слое», что исключает дополнительную травму селезенки и поджелудочной железы. Ротация селезенки и смещение ее к лапаротомной ране позволяют быстро наложить зажимы и остановить кровотечение. Поскольку при таком способе мобилизации зажимы нередко накладывают одновременно на «ножку» селезенки и желудочно-селезеночную связку, нужно быть очень внимательным, чтобы не захватить в зажим хвост поджелудочной железы и большую кривизну желудка. Перевязкой и пересечением селезеночно-ободочной и желудочно-селезеночной связок (если это не было выполнено на предыдущем этапе) заканчивают операцию.
Некоторые хирурги [4, 22] считают, что лигирование селезеночной артерии можно сочетать с органосохраняющей операцией на селезенке и это не приводит к увеличению послеоперационных осложнений в виде панкреатита и ишемии селезенки. Другие авторы [86] пишут: «…те селезенки, которые мы раньше могли сохранить во время операции, сейчас мы лечим без операции», поэтому если пострадавшему с травмой селезенки показана операция, то это всегда спленэктомия [90]. В пользу этого свидетельствует также то, что при закрытой травме в отличие от колото-резаного ранения объем внутриорганного повреждения неизвестен и чаще всего больше, чем его наружные проявления.
В своей практической деятельности мы поступаем следующим образом. Если по результатам осмотра принято решение о спленэктомии, кровотечение неинтенсивное, а анатомические условия сложные, мобилизацию проводим по «переднему» способу. Если кровотечение интенсивное и доступ к селезенке технически прост, выбираем «задний» способ. Если предполагается органосохраняющая операция, то селезеночную артерию не перевязываем, а берем на турникет, который снимаем после окончания оперативного приема на селезенке.
Пострадавшим со стабильной гемодинамикой и признаками травмы органов брюшной полости по данным УЗИ проводят КТ и уточняют возможность консервативной терапии. В травматологических центрах первого уровня в 50-75% наблюдений при травме селезенки начинают консервативную терапию [55, 61, 66]. Необходимыми организационными условиями консервативной терапии являются повторные осмотры, лабораторные и инструментальные методы обследования, постоянная доступность операционной и анестезиологической службы [76].
Эндоваскулярная эмболизация — это важная составляющая консервативной терапии [47, 59, 65, 75], хотя ее применяют менее чем в 10% наблюдений [38]. Показания к ангиографии и ее эффективность остаются предметом дискуссий. Большинство авторов полагают, что ангиография показана при IV-V степени повреждения селезенки, продолжающемся кровотечении (blush) [29], сосудистых повреждениях [56]. Некоторые авторы считают дополнительными показаниями к ангиографии гипотонию, не корригируемую инфузионной терапией, и необходимость в повторных гемотрансфузиях [34].
Показанием к эндоваскулярной операции служит обнаружение при ангиографии экстравазации контрастного вещества (в брюшную полость или интрапаренхиматозно), ложной артериальной или артериовенозной аневризмы. Косвенными показаниями являются «обрыв», спазм или тромбоз ветви селезеночной артерии. Существует три метода эмболизации. При проксимальной эмболизации осуществляют окклюзию ствола селезеночной артерии после отхождения от нее ветвей к поджелудочной железе (дорсальной панкреатической артерии). Дистальная (суперселективная) эмболизация предполагает идентификацию и окклюзию только поврежденного сосуда. Сочетание двух методов называют комбинированной эмболизацией. К каждому методу существуют свои показания, однако формат лекции для хирургов не позволяет обсудить этот вопрос. Проксимальная эмболизация более надежна и выполняется быстрее, но после нее чаще возникают осложнения, хотя J. Frandon и соавт. [44], B. Schnüriger и соавт. [71] c этим не согласны. К «большим» осложнениям эмболизации относят повторное кровотечение [88], абсцесс [78] селезенки и сепсис, панкреатит [62], тотальный инфаркт селезенки, к «малым» — инфаркт части селезенки [50]. Общие осложнения ангиографии (повреждение сосуда, нефропатия и пр.) в настоящей лекции также не обсуждаются.
По данным метаанализа J. Requarth и соавт. [66], включившего 10 157 пострадавших, консервативная терапия была успешной в 91,7% наблюдений. Очевидно, что чем строже критерии отбора пострадавших для проведения консервативной терапии, тем лучше ее результаты. Более успешна консервативная терапия повреждений селезенки в травматологических центрах первого уровня, университетских клиниках, стационарах, регулярно использующих ангиографию [28].
Предикторами неудачи консервативной терапии F. Carvalho и соавт. [36] считают общую тяжесть травмы и степень повреждения селезенки. В 2000 г. G. Velmahos и соавт. [81, 82] отмечали, что консервативная терапия при травме селезенки III и более степени и необходимости в переливании 1 л крови менее успешна, к 2010 г. они несколько изменили свое мнение [83] и называли такими факторами уже V степень травмы селезенки и черепно-мозговую травму.
Сколько времени наблюдать больного с травмой селезенки, которого лечат без операции? Известны случаи позднего разрыва селезенки [38, 67]. В ретроспективном исследовании R. Crawford и соавт. [39] обнаружили, что из 691 пострадавшего с травмой селезенки 499 (72%) проводили консервативную терапию, которая не увенчалась успехом у 36 (7%). У 26 пострадавших кровотечение возникло в первые 3 сут после поступления, у 7 — на 4-8-е сутки, у 3 — на 12-22-е сутки. У всех пострадавших с поздним кровотечением, кроме одного, оно возникло во время пребывания в стационаре, причиной которого были другие повреждения. Летальных исходов не было. Авторы делают вывод о том, что наблюдение пострадавшего с изолированной травмой селезенки в стационаре более 3 сут нецелесообразно.
Что делать при неудаче консервативной терапии? Если клиническая картина кровотечения очевидна, альтернативы открытой операции нет. Если продолжающееся кровотечение проявляется увеличением количества жидкости в брюшной полости по данным УЗИ, а гемодинамика продолжает оставаться стабильной, то целесообразно выполнить лапароскопическую спленэктомию [23, 26].
Остановку кровотечения из разрыва селезенки осуществляют с использованием швов, химического (Tachocomb, SURGICEL, 3% раствора натрия тетрадецил сульфата) или физического (ультразвукового, электрического, аргоно-плазменного) воздействия, однако в связи с крайней редкостью подобных наблюдений в этой лекции мы их не рассматриваем.
Аутотрансплантацию фрагментов [19, 45] или ткани [6, 12, 54] селезенки, довольно распространенную в 90-е годы XX века, в настоящее время применяют гораздо реже, поскольку доказать ее практическую пользу не удалось.
Послеоперационные осложнения и осложнения при проведении консервативного лечения пострадавшего с травмой селезенки включают повторное кровотечение, травматический панкреатит, инфильтрат и абсцесс левого поддиафрагмального пространства. Ятрогенная травма большой кривизны желудка может привести к некрозу его стенки, формированию абсцесса и желудочного свища. Лечение этих осложнений осуществляют по общим принципам хирургии. Автор лекции убежден, что тщательное соблюдение всех этапов операции сводит появление таких осложнений к минимуму.
Специфическое осложнение спленэктомии — overwhelming postsplenectomy infection (OPSI), или подавляющая постспленэктомическая инфекция, было описано H. King и H. Shumaker [52] у детей, оперированных по поводу различных гематологических заболеваний. Подавляющую постспленэктомическую инфекцию вызывают инкапсулированные микроорганизмы (пневмококки и менингококки), инфекция развивается очень быстро и приводит к летальному исходу в 50% наблюдений. Подавляющая постспленэктомическая инфекция у взрослых пациентов, оперированных по поводу травмы, в отличие от педиатрической популяции, является казуистикой [37]. J. Wang и соавт. [85] провели телефонный опрос 889 пациентов, перенесших спленэктомию, и обнаружили, что подавляющая постспленэктомическая инфекция имела место у одного из них, что составило 0,1%.
Во многих странах существуют рекомендации для пациентов после спленэктомии или с нефункционирующей селезенкой, которые включают обязательную вакцинацию, информирование и обучение пациентов и антибактериальную терапию, по требованию или постоянную [40], однако проверки показывают, что эти рекомендации плохо соблюдают и врачи, и пациенты [33, 41, 84].
Подводя итог, считаем нужным сказать, что тщательное следование изложенным принципам диагностики и лечения пострадавших с закрытой травмой селезенки позволяет снизить летальность и количество осложнений до минимальных значений. Так, в течение последних 25 лет в Научно-исследовательском институте скорой помощи им. Н.В. Склифосовского смерть больного с закрытой изолированной травмой селезенки является казуистикой.
Осложнения
Злокачественная опухоль может распространяться в головной, спинной мозг и вызывать неврологические осложнения. Сдавление нервов приводит к болям. Очаги в лимфатических узлах, которые находятся внутри грудной клетки, может привести к кашлю, затруднению дыхания, болям за грудиной.
Селезенка не является жизненно важным органом, поэтому после ее удаления человек может жить, как прежде, не испытывая каких-либо симптомов, связанных с ее отсутствием. Однако, в некоторой степени снижается иммунная защита, и пациент становится более уязвим к инфекциям.
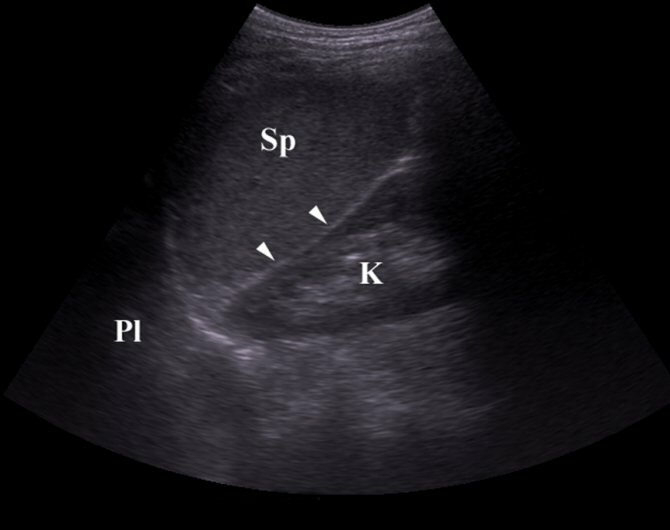
УЗИ селезенки: норма
В норме при УЗИ селезенки:
- эхогенность должна быть средняя;
- размер вены не более 5 мм, допускается сосудистая сетка в зоне ворот органа;
- серповидная форма;
- расположен орган в брюшной полости с левой стороны наверху;
- при косом срезе размер органа 12 см;
- при поперечном срезе размер органа до 8 см;
- толщина органа около 4 см;
- вес селезенки 150-250 грамм.
У здорового человека желудок должен находится у центра селезенки или немного ниже, хвост поджелудочной железы — у середины ворот органа. Немного ниже у середины селезенки располагается левая почка. В норме структура селезенки должна быть однородная, контур непрерывный.
Прогноз выживаемости
Прогноз зависит от типа, стадии, степени агрессивности опухоли. В частности, при лимфоме из клеток маргинальной зоны селезенки на прогноз влияют такие факторы, как возраст пациента, лейкоцитоз, лимфоцитоз, лейкопения, тромбоцитопения, анемия, поражение красного костного мозга и других органов, применение химиотерапии и моноклональных антител.
В одном из исследователей пациентов поделили на группы риска и подсчитали для них прогнозы пятилетней выживаемости (% пациентов, оставшихся в живых в течение 5 лет с момента диагностики заболевания):
- низкий риск — 88%;
- средний риск — 73%;
- высокий риск — 50%.
Воспалительные заболевания
На спленит острой формы при ультразвуковой диагностике указывает увеличение органа с округлением. Эхоструктура однородная мелкозернистая. Иногда — очаги острых некрозов. При хроническом сплените сохраняются увеличенные размеры селезенки из-за разрастания фиброза. Эхогенность ткани выше нормальной. Очаги некрозов могут быть кальцинированными. Кальцификаты на УЗИ видны как мелкие гиперэхогенные образования.
Часто на УЗИ выявляется спленомегалия — патологическое увеличение размеров селезенки. Оно может быть признаком различных заболеваний: болезни Гоше, амилоидоза, туберкулеза и других. В 75% случаев спленомегалия — симптом заболеваний других органов: цирроза печени, активного гепатита. В начальной стадии ультразвуковая диагностика показывает увеличение диаметра селезеночной вены. Постепенно наступает фиброз с усилением эхоструктуры.
Спленомегалия с нормальной эхоструктурой наблюдается при:
- инфекции,
- патологии печени,
- серповидной анемии,
- врожденном сфероцитозе,
- лейкозах,
- гемолизе,
- хронической анемии,
- болезни Стилла,
- Синдроме Фелти,
- болезни Вильсона,
- ретикулоклеточной саркоме.
Гипоэхогенность при увеличенной селезенке:
- гепатоцеллюлярная болезнь,
- лимфогрануломатоз,
- миелома,
- неказеозное гранулематозное воспаление,
- лейкозы.
Абсцессы редки, но возможны. Выглядят как анэхогенные или гипоэхогенные очаги с плохими границами, но видимыми стенками. Внутри бывают газовые пузырьки, создающие зоны высокой эхогенности. Для диагностики абсцессов используют также клиническую картину, нужно исключить гематому и инфаркт селезенки.
Профилактика
В настоящее время известно, что имеется связь между развитием злокачественных новообразований селезенки и такими инфекциями, как гепатит C, ВИЧ-инфекция, инфекция, вызванная вирусом Т-клеточной лимфомы. Рекомендуется соблюдать рекомендации, которые помогают предотвратить заражение:
- Используйте презервативы.
- Если решили сделать пирсинг или тату, выбирайте надежный салон.
- Нельзя делать инъекции использованными иглами.
Большое количество жиров в рационе и лишний вес — еще два фактора риска развития неходжкинской лимфомы. Нужно придерживаться здорового питания и поддерживать нормальный вес.
| Подробнее о лечении в «Евроонко»: | |
| Онколог-гематолог | 10500 руб |
| Приём химиотерапевта | 6900 руб |
| Скорая онкологическая помощь | от 11000 руб |
| Паллиативная терапия в Москве | от 40200 в сутки |
| Консультация радиолога | 10500 руб |
Запись на консультацию круглосуточно
+7+7+78