Комплексы с этим исследованием
Мониторинг сахарного диабета Мониторинг состояния больных сахарным диабетом (раз в 6 месяцев) 1 900 Р Состав
Расширенная мужская антивозрастная диагностика Расширенный контроль основных показателей у мужчины в возрасте 40+ 33 710 Р Состав
Расширенная антивозрастная диагностика в постменопаузе Расширенный контроль возрастных изменений в период постменопаузы 29 230 Р Состав
В ДРУГИХ КОМПЛЕКСАХ
- Расширенная женская антивозрастная диагностика 28 680 Р
- Мужская антивозрастная диагностика 13 300 Р
- Антивозрастная диагностика в постменопаузе 12 630 Р
- Женская антивозрастная диагностика 12 070 Р
Наблюдение после лечения
Позвоните своему врачу, если у вас после процедуры присутствуют:
- Лихорадка,
- Проблемы с дыханием,
- Сыпь,
- Область, в которую был вставлен катетер, становится красной, опухшей и болезненной, или сочится кровью.
- Боль в животе или боку на стороне обработанной почки.
- Очень низкое давление.
После стентирования почечной артерии необходимо избегать интенсивной физической активности в течение как минимум 24 часов и потреблять много жидкости, чтобы вымыть контрастный краситель.
Вы можете выполнять лёгкие действия на следующий день, но должны избегать тяжёлого физического труда или напряжённой деятельности в течение пяти дней. Стентирование почечных артерий — современный высокотехнологичный метод лечения вазоренальной гипертензии и значительно превосходит по безопасности открытые вмешательства на этих сосудах.
Подробное описание исследования
В норме организм человека поддерживает баланс поступления и расхода углеводов. Во многом это возможно за счет гормонов поджелудочной железы — инсулина (образуется в бета-клетках железы) и противоположного ему по действию гормона — глюкагона (продуцируется в альфа-клетках поджелудочной железы).
Одна из главных функций инсулина в углеводном обмене — нормализация уровня глюкозы в крови. Он осуществляет эту функцию путем транспорта глюкозы в клетки, так называемых инсулинозависимых тканей, которые чувствительны к его действию и могут получать глюкозу из крови через специальные переносчики (GLUT) только при действии инсулина. К инсулинозависимым тканям относят печень, мышечную и жировую ткани.
При сахарном диабете 1 типа нарушается процесс образования инсулина на фоне разрушения клеток поджелудочной железы, за счет чего уровень глюкозы в крови становится избыточным для организма. При сахарном диабете 2 типа, в отличие от 1 типа, инсулин вырабатывается в достаточном или иногда в избыточном количестве (т.н. гиперинсулинемия). Это связано с тем, что чувствительность инсулинозависимых тканей к действию данного гормона снижена. В результате они не могут захватывать глюкозу из крови, такое состояние называется «инсулинорезистентность» (IR).
Усугубление резистентности тканей к инсулину клинически связано с избыточной массой тела и ожирением. Во-первых, из-за того, что количество GLUT-рецепторов у людей с избыточным весом меньше, чем у лиц с нормальной массой тела. Во-вторых, избыточный вес приводит к патологическому отложению липидов (жиров) в тканях-мишенях инсулина, особенно в мышцах и печени, это приводит к токсическому эффекту, который нарушает действие инсулина и ухудшает взаимодействие с GLUT-рецепторами.
Возникает порочный цикл — инсулинорезистентность повышает уровень глюкозы в крови, а глюкоза, в свою очередь, повышает степень инсулинорезистентности. Такое состояние часто сопровождает т.н. преддиабет, а затем сопутствует сахарному диабету. Преддиабет (преддиабетическое состояние) — это пограничное состояние, для которого характерно нарушение обмена глюкозы, однако его степень еще недостаточно выражена для постановки диагноза «сахарный диабет». При отсутствии своевременной диагностики и лечения преддиабет может перейти в сахарный диабет.
Для оценки инсулинорезистентности разработан индекс HOMA-IR — формула, учитывающая уровень глюкозы и инсулина — оба показателя натощак. Индекс инсулинорезистентности имеет больший диагностический потенциал, нежели показатели глюкозы и инсулина отдельно. Чем выше показатель HOMA-IR, тем хуже ткани поглощают глюкозу и тем хуже течение сахарного диабета (или преддиабета).
Инсулинорезистентность также отмечается на фоне системных заболеваний — атеросклероз, ишемическая болезнь сердца и др. Также снижение чувствительности тканей к инсулину отмечается у большинства пациентов при синдроме поликистозных яичников или приеме глюкокортикостероидов, что может впоследствии приводить к диабету.
Инсулинорезистентность часто служит составляющей метаболического синдрома — состояния, характеризующегося ожирением, нарушением липидного и углеводного обмена. У пациентов с метаболическим синдромом HOMA-IR помогает оценить эффективность лечения.
Материалы и методы
В ретроспективное исследование включили 53 больных с признаками ХБП, находившихся под наблюдением в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева в период с января 2003 г. по октябрь 2013 г. Среди них 25 (47,2%) женщин и 28 (52,8%) мужчин; средний возраст составил 44,4±13,6 года.
Всех больных разделили на две сопоставимые по численности группы: 26 с преобладанием гломерулярной патологии (хронический гломерулонефрит — ХГН) и 27 с тубулоинтерстициальными повреждениями, в частности 9 пациентов страдали тубулоинтерстициальным нефритом (ТИН), 4 — хроническим пиелонефритом, 6 — поражением почек, ассоциированным с гипертонической болезнью, 5 — с антифосфолипидным синдромом, оставшиеся — поликистозом почек. При первой госпитализации анализировали клинические, инструментально-лабораторные данные пациентов: возраст, суточная ПУ, СКФ (рассчитывали по формуле CKD-EPI), систолическое и диастолическое артериальное давление, пульсовое давление (ПД), ИР по данным УЗДГ. Для определения темпов прогрессирования почечной недостаточности в динамике оценивали СКФ. Снижение СКФ на 10 мл/мин/1,73 м2 расценивали как снижение функции почек. Период наблюдения пациентов составил 14±2,64 мес.
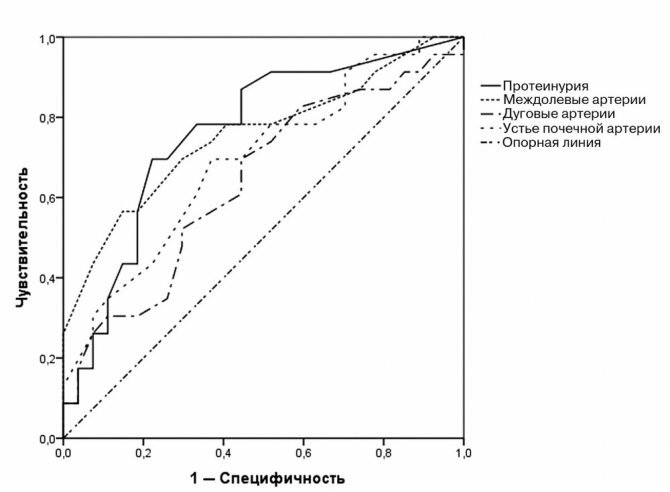
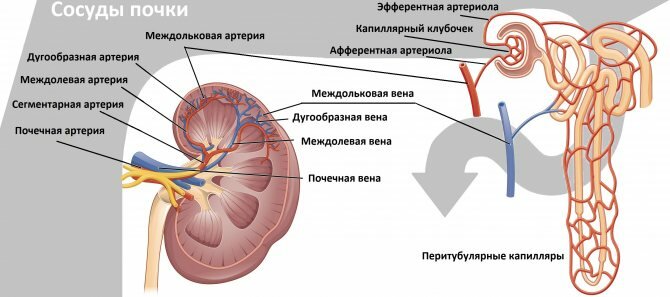
Стандартное УЗИ, УЗДГ провели всем 53 пациентам на ультразвуковом аппарате экспертного класса Sonoline Antares («Siemens Medical Solutions») с использованием датчика с частотой 1—5 МГц. Измеряли длину и поперечный размер почек, толщину почечной паренхимы с последующим расчетом средних значений. Паренхимопиелический индекс (ППИ) вычисляли как отношение размера паренхимы к размеру центрального эхокомплекса, который включает чашечно-лоханочную систему с жировой тканью, кровеносные и лимфатические сосуды [7]. ИР — это отношение разницы между максимальной систолической скоростью и конечной диастолической к максимальной систолической скорости, определявшийся для почечной артерии (ПА), междолевых артерий (МА) и дуговых артерий почек. Для сравнительного анализа корреляции в независимых выборках между количественными данными применяли критерий Пирсона (где р
<0,05 оценивали как статистически значимый результат). При расчете коэффициентов корреляции взято среднее значение ИР артерий почек на основании того, что данный показатель варьирует незначительно между органами [8].
Для оценки прогностической значимости ИР ПА, сегментарных артерий (СА) и МА, их чувствительности и специфичности, применяли ROC-анализ с построением одноименных кривых.
Для определения факторов, влияющих на внутрипочечную гемодинамику, применяли пошаговый многофакторный регрессионный анализ.
Техника
Цель сканирования – визуализировать все почечные артерии на всем их протяжении от аорты до уровня сегментарных и междолевых артерий. Кроме того, всегда следует оценивать размер почек (по крайней мере, в двух измерениях), кортикомедуллярную дифференцировку почек и наличие очаговых поражений или гипотонии коллективной системы.
Для трансплантированных почек важно искать потенциальные скопления околопочечной жидкости, которые могут указывать на патологический процесс или неправильную хирургическую технику.
Сканирование всегда начинается с морфологической оценки почек и почечных сосудов на изображениях в B-режиме; с последующей цветовой оценкой кровотока с особым вниманием к так называемым областям сглаживания, которые указывают на турбулентный кровоток и, следовательно, на возможный стеноз или артериовенозную фистулу.
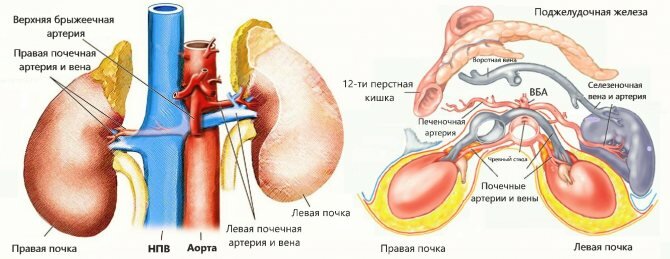
Периаортальные сегменты почечных артерий лучше всего оценивать в поперечной плоскости (перпендикулярной аорте), перемещаясь от средней линии к среднеключичной линии у пациента в положении лежа на спине. Следует отметить, что почечные артерии отходят от аорты, немного ниже (примерно 1,5–2 см) верхней брыжеечной артерии, при этом правая почечная артерия выходит из ее переднебоковой стороны, а левая почечная артерия выходит немного ниже, из ее задней части бокового аспекта.
Визуализация левой почечной вены упрощает идентификацию левой почечной артерии; артерия расположена немного глубже вены. Правая почечная артерия заметно длиннее и проходит от задней части к правой почечной вене и нижней полой вене; обе венозные структуры могут мешать диагностическому отображению с цветовым кодированием и соответствующей спектральной записи.
Может случиться так, что, несмотря на оптимальную визуализацию артериальных стволов на B-режиме и изображениях с цветовой кодировкой, а также попытки наклонить датчик, получить диагностические значения угла допплеровского исследования невозможно. В таких случаях следует попытаться выполнить сканирование в продольной плоскости у пациента, находящегося в левом положении лежа, – так называемый «вид кожуры банана». Оценка перихилярного и внутрихилярного сегментов выполняется у пациента в положении лежа, когда противоположная рука поднимается высоко за голову, а нога полностью разгибается; для правой стороны – по передней или средней подмышечной линии, а для левой стороны – по средней или задней подмышечной линии.
Спектральная запись кровотока – заключительный этап ультразвуковой оценки. Артериальная васкуляризация оценивается в парааортальном сегменте (для пересаженных почек – около анастомоза с подвздошной артерией и вокруг него), центральном и перихилярном сегменте ствола почечной артерии, а также на внутрипочечном уровне, по крайней мере, на трех уровнях: верхний полюс, центральная часть и нижний полюс почки.
В то время как получение подходящего угла обзора (<60 °) на уровне ствола основной почечной артерии играет ключевую роль для интерпретации гемодинамических параметров, угловая коррекция не требуется на внутрипочечном уровне, если нет оценки параметра AI (индекса ускорения).
Измерения скорости кровотока выполняются в продольной проекции / продольном сечении сосуда с заслонкой, расположенной в центральной части потока, которая в нормальных условиях соответствует центру сосуда. Размер ворот должен составлять ½ – свободного просвета кровеносного сосуда (на практике 1,5–2,0 мм).
Допплеровские спектральные пробы следует записывать во время вдоха пациента, когда сканирование выполняется в положении лежа, или во время задержки дыхания, когда датчик прикладывают по средней линии; поэтому респираторная кооперация пациента имеет ключевое значение.
Список литературы
- Eik-Nes, S., Marsal, K. and KristolTerscn. K. (1984). Methodology and basic problems related to blood, now studies in the human fclus. Ultrasound Med. Rio!., 10. 329-37
- WladimirofF, J. W., Tonge, H. M. and Stewart, P. A. (1986). Doppler ultrasound assessment of cerebral blood flow in the human fetus. Br. J. Obsiet. Civnaeco!.. 93, 461-75
- Gudmundsson, S. and MarSal, K. (1988). Umbilical and uteroplacental blood flow velocity waveforms in pregnancies with fetal growth retardation. Eur. J. Obslel. Gynecol. Reprod. Bioi, 27. 187-96
- Gudmundsson, S., Eik-Nes. S.. Lingman, G., Vernersson. E., Grip, A., Kristoffersen, K. and Marsal, K. (1990). Evaluation of blood flow velocity indices in an animal model. Echocardiographv. 7. 647-53
- Gosling, R. G., Dunbar. G., King, D. H., Ncwman, D. L.. Side, C. D., Woodcoock, J. P., FitzGerald, D. E., Keates. J. S. and MacMillan, D. (1971). The quantitative analysis of occlusive peripheral arterial disease by a non-intrusive ultrasonic technique. Angiology, 22, 52-5
- FitzGerald. D. E. and Dumm, J. E. (1977). Non-invasive measurement of human fetal circulation using ultrasound: a new method. Br. Med. J., 2. 1450-1
- Lindheimer, M. D., Chesley L. C., Taylor, J. R. Spargo, B. H. and Katz. A. I. (1987). Renal function and morphology in hypertensive disorders of pregnancy. In Sharps, F. and Symonds, E. M. (eds.) Hypertension in Pregnancy. pp. 73 91. (Ithaca, New York: Perinatal Press)
- Thorburn. G. D., Kopald, H. H., Herd, J. A., Hollenberg, M., O’Marchoc, C. C. C. and Barger, A. C. (1963). Intrarenal distribution of nutrient blood flow determined with Krypton 85 in unanesthetized dog. Circ. Res., 13, 290-303
- Hollenberg, N. K., Epstein, M., Rosen, S. M.. Basch, R. I., Oken, D. E. and Merrill, J. P. (1968). Acute oliguric renal failure in man: evidence for preferential renal cortical ischemia. Medicine, 47, 455-74
- Trueta, J., Barclay, A. E., Daniel, P.M., Franklin, K. J. and Pritchard, M. M. L. (1947). Studies of the Remit Circulation. (Springfield, 111.: Charles C. Thomas)
- Nettcrs. F. H. (1973). A Compilation ft)’Paintings on the Kidneys. Ureters and Urinary Bladder, pp. 18-19. (New Jersey: Ciba-Geigy)
- Hata, T., Hata, K., Aoki, S.. Takamiya, 0., Murao, F. and Kitao. M. (1987). Renal arterial blood Fiovv velocity waveforms in pregnant women. Am. J. Obstel. Civnecol.. 57, 1269-71