Доброкачественная опухоль легких развивается из патологических клеток их тканей. Она может отличаться в зависимости от строения, локализации и размеров. Среди доброкачественных новообразований встречаются такие виды, как липома, хондрома и фиброма легких. Статья ниже расскажет, чем эти опухоли отличаются и почему они опасны для здоровья человека. Несмотря на свою доброкачественность, новообразования являются серьезной патологией, требующей срочного лечения. В Москве качественное лечение опухолевых заболеваний легких выполняют в Юсуповской больнице.
Хондрома, липома, фиброма легких: основные отличия
Доброкачественные опухоли легких встречаются с одинаковой частотой у женщин и мужчин. Наиболее часто их выявляют в молодом возрасте. Они отличаются строением и локализацией. Доброкачественные новообразования формируются из клеток высокой дифференциации, которые имеют схожее строение со здоровыми клетками. Главными отличиями доброкачественных образований от злокачественных являются:
- Относительно медленный рост;
- Они не разрушают соседние ткани;
- Отсутствие метастазирования.
В зависимости от локализации опухоли бывают центральные и периферические. Центральные обычно произрастают из крупных бронхов, а периферические – из стенок мелких бронхов и соседних тканей. Периферические опухоли встречаются статистически чаще, чем центральные.
Другой отличительной характеристикой новообразований является их строение. В зависимости от вида клеток, из которых они сформированы, выделяют:
- Фибромы;
- Хондромы;
- Липомы.
Фиброма состоит из клеток соединительной ткани. Она с одинаковой частотой поражает правое и левое легкое. В среднем ее размер составляет 2-3 см в диаметре, но в запущенных случаях она может достигать гигантских масштабов. Фиброма легкого имеет вид плотного узла с хорошо сформированной капсулой с ровной поверхностью.
Хондрома состоит из элементов зародышевой ткани (хряща, жировой прослойки, желез, гладкомышечных волокон, лимфоидной ткани). Наиболее часто отмечается периферическая локализация с ростом в толщу легочной ткани. Хондрома отличается медленным ростом, может годами себя никак не проявлять. Опухоль не имеет капсулы, у нее округлая форма, гладка поверхность. Хондрома четко отделяется от окружающих тканей.
Липома – это новообразование из жировых клеток, которые разделены соединительнотканными перегородками. В легких этот вид опухоли встречается достаточно редко. В основном имеет центральную локализацию. Рост опухоли медленный. Липома имеет четко выраженную капсулу эластичной консистенции, у нее округлая форма.
ПОВЕРХНОСТНЫЕ ДОБРОКАЧЕСТВЕННЫЕ ОБРАЗОВАНИЯ КОЖИ
Атерома
Атерома — наиболее частое хирургическое заболевание придатков кожи, встречающееся одинаково часто у лиц обеих полов. Представляет собой опухолевидное кистозное образование, происходящее из сальной железы.
Внутренняя поверхность атеромы выстлана плоским эпителием, в полости её выявляют детрит, ороговевшие клетки эпидермиса, капли жира, кристаллы холестерина. Среди факторов способствующих развитию атеромы наиболее часто выделяют неблагоприятное воздействие внешней среды (хроническая травма) и нарушение обмена веществ (повышенная кожная секреция, особенно в период полового созревания).
Располагается атерома чаще всего на участках кожи, содержащих большое количество сальных желез: кожа волосистой части головы, надбровных дуг, щек, носогубного треугольника, задней поверхности шеи, межлопаточного пространства, крестца, промежности, мошонки и половых губ. При осмотре атерома представляет собой опухолевидное образование округлой формы, мягкой консистенции размером от 5 до 40 мм и более. Кожа над атеромой обычно не изменена, однако в случае присоединения вторичной инфекции может иметь красноватый оттенок. Атерома подвижна вместе с окружающими тканями, безболезненна. Атерома может оставаться маленькой на протяжении многих лет, либо увеличиваться. Иногда атерома сообщается с поверхностью кожи через небольшое отверстие, через которое могут отделяться атероматозные массы. Часто атеромы нагнаиваются, кроме этого, может происходить разрыв атеромы в подкожную клетчатку. Атерома не является смертельно опасным заболеванием и показанием к ее удалению являются большой размер атеромы и желание больного (косметический эффект), абсолютным показанием к хирургическому лечению является инфицированние атеромы. Операция проводится обычно в амбулаторных условиях (при больших атеромах и сложной локализации может быть показана госпитализация) под местной инфильтрационной анестезией. Залогом успешного радикального лечения является удаление атеромы вместе с капсулой.
Липома
Липома (жировик, липобластома) — доброкачественная опухоль, развивающаяся из жировой ткани. Липому чаще диагностируют у женщин в возрасте от 30 до 50 лет; локализована в коже и подкожной жировой клетчатке любой анатомической области. Липома может развиваться в любом месте организма, где есть жировая ткань: подкожная клетчатка, забрюшинная клетчатка, околопочечная клетчатка, средостение, легкие, молочная железа и пр. Липома иногда достигает больших размеров.
Клинически подкожная липома проявляется в виде округлого, подвижного, не спаянного с окружающими тканями и кожей, безболезненного образования, при растягивании кожи над которым появляются втяжения, за счет дольчатого строения опухоли. Размеры липомы варьируют от горошины до головы ребенка, обычно от 1,5 до 5 см, встречаются также гигантские липомы. Обычно образование мягкой, мягко-эластической консистенции (lipoma molle), а при выраженном развитии соединительной ткани она становится более плотной (lipoma durum). Интрамуральная (инфильтрирующая) липома располагается в толще мышц, не имеет чётких границ. Множественные мелкие липомы, расположенные по ходу нервных стволов, иногда болезненны вследствие давления на нерв. Диагноз при глубоколежащих липомах затруднителен, устанавливают его только при гистологическом исследовании. Липома долгое время может оставаться неизменённой или расти очень медленно. Под влиянием травмы или без явной причины липома приобретает характер злокачественной опухоли с инфильтрацией соседних тканей. Лечение липомы исключительно оперативное. Никакими «народными средствами» вылечить липому невозможно.
При небольших по размеру опухолях с доступной локализацией оперативное лечение проводят под местной инфильтрационной анестезией в амбулаторном порядке. При больших липомах, липомах, расположенный в сложных анатомических областях (липомы шеи, подмышечной впадины), рекомендуется госпитализация и оперативное лечение в условиях стационар.
Классическое иссечение липомы с капсулой — является наиболее радикальным методом лечения. Под местной анестезией широким разрезом кожи липома вылущивается и удаляется вместе с капсулой, накладываются швы на подкожную клетчатку и кожу, при больших размерах опухоли на один-два дня оставляется дренаж. Достоинством данного подхода является высокий радикализм и отсутствие рецидивов опухоли, недостатки — недостаточный косметический эффект. Фиброма Фиброма — доброкачественная опухоль, образованная зрелыми элементами соединительной ткани. Возникает в любом возрасте, примерно с одинаковой частотой у мужчин и женщин. К собственно фиброме на сегодняшний день принято относить хорошо отграниченное разрастание зрелой и богатой коллагеном соединительной ткани, которое часто имеет ножку и расположено на поверхности тела и слизистых оболочках. Опухоль, как правило, не склонная к озлокачествлению, растет медленно и может достигать огромных размеров (головы взрослого человека), либо останавливать свой рост на определенном этапе. Клинически представляет округлое или овальное образование, гладкой или бугристой формы, плотной консистенции, безболезненное, часто на ножке. Локализоваться фиброма может в любой области, где есть соединительная ткань, чаще в коже или подкожной клетчатке.
Лечение фибромы оперативное, в зависимости от локализации и размеров может быть выполнено амбулаторно или требует госпитализации. При небольших размерах опухоли под местной анестезией производят ее иссечение вместе с фрагментом кожи и ножкой, либо вылущивают из окружающих тканей. Прогноз благоприятный, рецидивы очень редки. Десмоид Десмоид — соединительнотканное кистозное новообразование, содержащее элементы эктодермы. Развивается из сухожильных и фасциально-апоневротических структур, характерен инфильтрирующий рост.
Возникает при нарушениях эмбриогенеза обычно в местах слияния эмбриональных борозд и полостей, где образуются идущие вглубь складки эпидермиса. Может возникать в различных частях тела: на коже головы, в переднем средостении, яичниках, брюшной стенке, толще забрюшинной и тазовой клетчатки, реже в печени, почках, в костях черепа, головном мозге и его оболочках. Диагностируют чаще у рожавших женщин в возрасте 25-35 лет. По клиническому течению занимает промежуточное место между доброкачественно протекающей фибромой и фибросаркомой. Десмоиды иногда неправильно диагностируют как фибросаркому, однако они биологически доброкачественны.
Клинически десмоид — одиночная, плотная, безболезненная опухоль, расположенная обычно в грудной или передней брюшной стенке. Растёт медленно. Обычно имеет округлую, не всегда правильную форму, гладкую или слегка бугристую поверхность, плотноэластическую или тестоватую консистенцию. Диаметр его от нескольких миллиметров до 15 см и более. Десмоид бывает однокамерным, заполнен салоподобной либо желеобразной сероватой или буроватой массой, содержащей чешуйки эпидермиса, волосы, кристаллы холестерина, аморфный жир, костные включения, зубы. Внутренняя поверхность покрыта эпидермисом с придатками кожи. Стенка состоит из плотной соединительной ткани с участками обызвествления, иногда содержит хрящевую или костную ткань.
Обычно для десмоида характерен медленный рост и доброкачественное течение. Десмоид больших размеров может вызвать нарушение функции соседних органов, а длительное давление десмоида на кости может привести к их атрофии. Содержимое десмоида может прорваться в соседние полости или на поверхность кожи, в ряде случаев возможно гнойное воспаление десмоида. В 5-8% случаев наблюдают малигнизацию, при этом чаще развивается плоскоклеточный рак. Признаки малигнизации: быстрый рост опухоли, прорастание её в окружающие ткани, изъязвление и метастазирование. В диагностике большое значение имеет рентгенологическое исследование, эхотомография и КТ.
При подозрении на десмоид больного следует направить к онкологу. Лечение оперативное. В стационаре проводят оперативное вмешательство — широкое иссечение опухоли в пределах здоровых тканей. Прогноз при своевременном лечении благоприятный, рецидивы возникают редко.
Доброкачественная опухоль легких: симптомы
Чаще всего патология протекает бессимптомно и может обнаружиться случайно. Клинические проявления возникают, когда опухоль становится значительных размеров и начинает нарушать работу дыхательной системы.
Большие опухоли периферической локализации могут достигать грудной клетки или диафрагмы, вызывая локальные боли, боли, которые можно принять за нарушение работы сердца, отдышку. Новообразование может сдавливать крупные бронхи, ограничивая их проходимость, а также провоцировать нарушение целостности кровеносных сосудов. В результате возникает кровохарканье и легочное кровотечение.
Опухоли центральной локализации имеют три степени клинической выраженности:
- Частичный бронхиальный стеноз. На этой стадии сужение просвета бронхов незначительное. У больного может возникать периодический кашель (редко с кровохарканьем). Общее состояние нормальное. На І стадии новообразование не удается обнаружить с помощью рентгенографии. Информативными будут бронхоскопия, бронхография, компьютерная томография.
- Клапанный (вентильный) бронхиальный стеноз. На этой стадии опухоль сдавливает большую часть просвета бронха, провоцируя клапанный или вентильный стеноз. Для вентильного стеноза характерно частичное открытие просвета бронха на вдохе и закрытие на выдохе. В области легкого, где произошел стеноз, начинает развиваться экспираторная эмфизема. В результате недостаточного вентилирования скапливается мокрота и кровь, что провоцирует воспалительный процесс. У больного повышается температура тела, появляется кашель с мокротой или кровью, боли в груди, общая слабость.
- Окклюзия бронха. Опухоль полностью перекрывает просвет бронха. В этой области начинает развиваться нагноение и некроз тканей. Степень выраженности поражения будет зависеть от объемов опухоли и размеров пораженного участка. У больного отмечается высокая температура, кашель с гнойным отделяемым и кровью, приступы удушья, плохое самочувствие.
Хондрома, липома, фиброма легких: дифференциальная диагностика
Чтобы выявить опухоль и определить ее характер, назначают инструментальные методы исследования. Они позволят узнать вид новообразования и дифференцировать его с другими опухолями, в том числе и злокачественными. Среди наиболее информативных методов диагностики выделяют:
- Рентгенография;
- Компьютерная томография;
- Бронхоскопия с дальнейшим цитологическим исследованием образца опухоли;
- Трансторакальная аспирационная или пункционная биопсия легкого;
- Торакоскопия с биопсией.
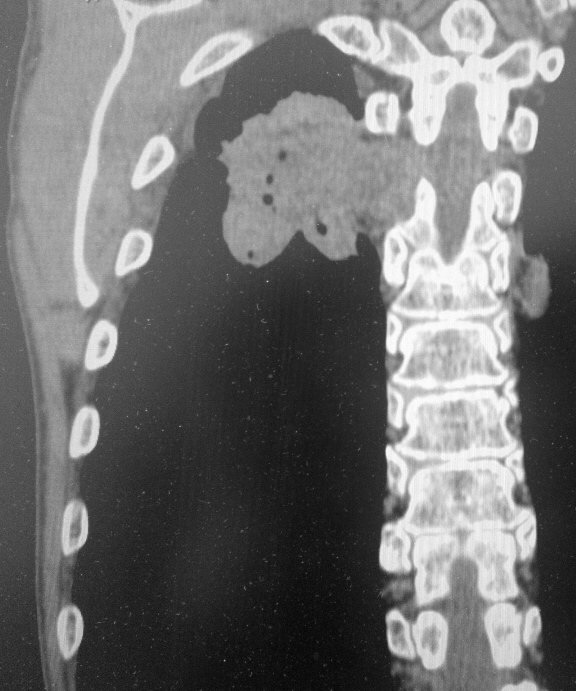
КТ-диагностика рака легкого
РАСПРОСТРАНЕННОСТЬ РАКА ЛЕГКОГО И ФАКТОРЫ РИСКА
Рак легкого — опухоль из эпителия бронхов — одно из самых распространенных онкологических заболеваний в мире. Ежегодно у более чем 10000 тысяч человек в России выявляются злокачественные новообразования органов дыхания, а в мире этот показатель еще выше. Бронхогенные злокачественные опухоли – одна из наиболее частых причин смерти от онкологических болезней и наиболее встречаемый вариант онкопатологии трахеобронхиального дерева.
К факторам риска рака легкого относятся:
1) Проживание в экологически неблагоприятных районах.
2) Работа на производствах, связанных с вдыханием частиц пыли, металлов, паров краски и активных химикатов даже со средствами защиты. Наиболее неблагоприятно вдыхание асбестовой пыли, затем – угольной пыли, а также паров тяжелых металлов, мышьяка, хлорметилового эфира, хрома, иприта.
3) Курение табака – основной предрасполагающий фактор новообразований трахеобронхиального дерева. У активных курильщиков риск развития онкопатологии до 10 раз выше, чем у некурящих, у пассивных – до 2 раз.
4) Специфические заболевания. Существует прямая связь между туберкулезом, асбестозом, силикозами, другими заболеваниями, проявляющимися диффузным либо локальным пневмосклерозом, и злокачественными новообразованиями бронхов.
ПРОЯВЛЕНИЯ РАКА ЛЕГКОГО — КОГДА МОЖНО ЗАПОДОЗРИТЬ БОЛЗЕНЬ?
Чтобы не пропустить первые признаки и симптомы рака легких, обязательно нужно обращать внимание на следующие изменения в самочувствии: появление кашля с мокротой с прожилками крови, резкое снижение веса без видимых на то причин, повышение температуры тела, особенно в виде «пиков», сопровождающихся ознобом, повышенным потоотделением.
Прямым показанием к проведению КТ служит обнаружение при флюорогрофическом исследовании или при рентгенографии четко очаговой тени на снимке. Конечно, рак легких на рентгене выглядит не очень специфично – ведь похожие изменения могут быть обусловлены также туберкулезом, другими доброкачественными опухолями, и даже пневмонией. Все эти состояния могут быть дифференцированы с помощью КТ.
Сделать МСКТ легких в Санкт-Петербурге
КАК ВЫЯВИТЬ РАК ЛЕГКИХ?
Рентгенография при раке легкого выявляет округлую тень слева. С целью дифференциальной диагностики (отличить рак легкого от туберкуломы, кисты или пневмонии) необходимо выполнять компьютерную томографию — КТ.
Самый эффективный способ диагностики при раке легкого – мультиспиральная компьютерная томография (МСКТ). В большинстве случаев, чтобы увидеть опухоль на компьютерных томограммах, не нужно вводить контраст. Контрастное усиление используется в основном в диагностике центральных опухолей с целью отличить небольшой мягкотканный узел в корне легкого от расположенных вблизи него легочных сосудов. КТ — незаменимый метод при определении размеров опухоли, степени поражения корня легкого, средостения и грудной клетки, оценки поражения лимфатических узлов. Все эти подробности в конечном счете определяют стадию онкологического процесса, поэтому точный анализ результатов компьютерной томографии крайне важен для прогноза.
Другой томографический метод исследования — магнитно-резонансная рентгенография (МРТ) почти не применяется для диагностики легочных новообразований, так как плохо выявляет изменения легочной ткани. Дело в том, что легочная ткань содержит большое количество воздуха, не дающего сигнала на МРТ.
С помощью ультразвукового исследования (УЗИ) также нельзя достоверно диагностировать изменения легочной ткани, однако этот метод может применяться для выявления изменений окружающей плевры.
Рентгенография и рентгеноскопия могут применяться для обнаружения легочных образований, однако изолированное применение этих методов не позволяет достоверно определиться с диагнозом. Бронхография как способ выявить рак легких также ушла в прошлое.
Из инструментальных методов диагностики центральных опухолей очень хороша фибробронхоскопия (ФБС) — эндоскопический метод, благодаря которому можно не только увидеть сужение просвета бронха глазами, но и взять часть объемного образования для гистологического исследования. ГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ РАКА ЛЕГКОГО И ПРОГНОЗЫ ВЫЖИВАЕМОСТИ
Согласно гистологической классификации бронхогенного рака последнего пересмотра (от 1999 г.) выделяют 6 видов опухолей трахеобронхиального дерева:
1) Аденокарцинома – выявляется приблизительно в 35% всех случаев. Чаще всего это периферическая опухоль, выглядящая как одиночный (солитарный) узел различных размеров с типичными признаками злокачественности, с наличием спикул – лучистых краев, которые образуются за счет прорастания рака по лиматическим сосудам; участков некроза, распада и кровоизлияний в строму опухоли. Аденокарцинома часто и рано метастазирует. Прогноз очень вариабелен, во многом он зависит от того, насколько рано было обнаружено образование.
2) Плоскоклеточный неороговевающий рак – часто встречающийся вариант – до 35% всех случаев образований легких. Характеризуется наилучшим прогнозом, редко метастазирует. Примерно в 65% развивается в одном из центральных бронхов и обуславливает картину ателектаза на КТ и рентгеновских снимках, в 35% развивается в периферических бронхах и выглядит как солидный единичный узел, часто с полостью распада в центре, похожий на абсцесс.
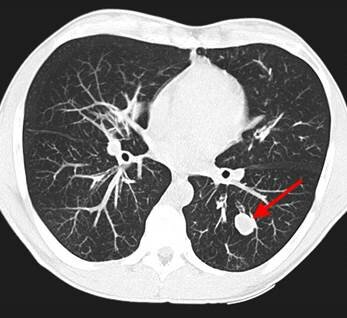
У пациента был выявлен раковый узел в 6 сегменте нижней доли слева. После резекции путем гистологического исследования верифицирован плоскоклеточный рак легкого. Томография в данном случае не дала типичную картину злокачественного новообразования.
3) Мелкоклеточный рак – самый агрессивный и наиболее опасный вид, уже на ранних стадиях может метастазировать в лимфоузлы корней легких и средостения. Продолжительность жизни пациентов с такими новообразованиями варьирует в зависимости от стадии (TNM) и возможности оперативного лечения. Частота встречаемости до 20%. Обычно возникает из эпителия крупных бронхов, обуславливает картину ателектаза. Тесно связан с курением.
4) Крупноклеточный недифференцированный рак – встречается редко, менее чем в 5% случаев. Представлен обычно одним солидным периферическим узлом большого размера. Практически всегда возникает у курильщиков. Рано метастазирует — гематогенно и лимфогенно, прогноз при нем неблагоприятен.
5) Крупноклеточный нейроэндокринный рак (карциноид) – чаще центральный, с характерным признаком – распадом в опухоли, встречается менее чем в 5% случаев, рано метастазирует в лимфоузлы, агрессивен, протекает неблагоприятно.
6) Бронхиоло-альвеолярный рак – до 2%. Является подтипом аденокарциномы. Практически всегда периферический. Проявляется диффузным снижением плотности легочной паренхимы по типу «матового стекла», что симулирует картину пневмонии. Проявляется также изменениями по типу консолидации – диффузным уплотнением легочной паренхимы, может выглядеть как узел. Прогноз при небольших размерах узла обычно благоприятный.
КАК ВЫГЛЯДИТ РАК ЛЕГКОГО ПРИ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ
Существует несколько вариантов роста опухолевого узла (по Розенштрауху):
1) В просвет бронха с одной стороны, суживая его – эндофитный тип.
2) В просвет бронха, циркулярно суживая его – это также эндофитный тип.
3) В просвет бронха и кнаружи от него – смешанный тип роста.
4) По ходу стенки бронха, не суживая его просвет – перибронхиальный тип.
При прорастании опухоли в просвет бронха происходит его сужение, что влечет нарушение вентиляции определенного участка ткани легкого. При КТ при этом можно заметить непосредственно сам опухолевый узел в просвете бронха – он выглядит плотным (белым). Просвет бронха сужен по кругу, пристеночно, либо «обрывается» на границе с новообразованием. Можно увидеть также повышение плотности соответствующей доли (либо сегмента, сегментов), вентилируемого данным бронхом. Повышение плотности может быть обусловлено ателектазом – спадением участка легочной ткани в результате нарушения проходимости бронха, дистелектазом – частичным спадением, а также изменениями, обусловленными пневмонией, чаще всего застойного характера, с абсцедированием, а также пневмофиброзом.
Сделать КТ легких в Санкт-Петербурге
Существует также деление рака легкого на периферический и центральный – классификация последнего приведена выше. Центральный рак клинически протекает более тяжело в связи с тем, что чаще дает осложнения в виде ателектаза, массивных пневмоний, абсцедирования, дыхательной недостаточности.
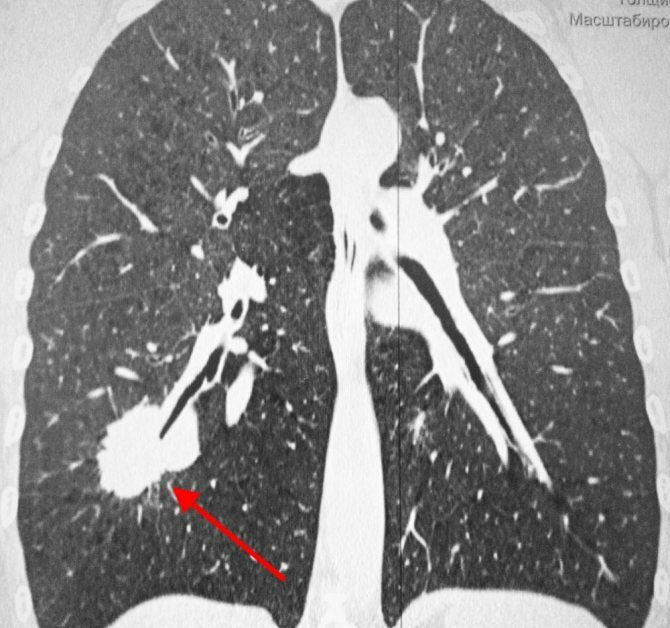
КТ-признаки центрального рака легкого: при компьютерной томографии определяется объемное образование мягкотканной структуры, в котором «обрывается» просвет нижнедолевого бронха. Края образования бугристые, неровные, со спикулами, форма неправильная.
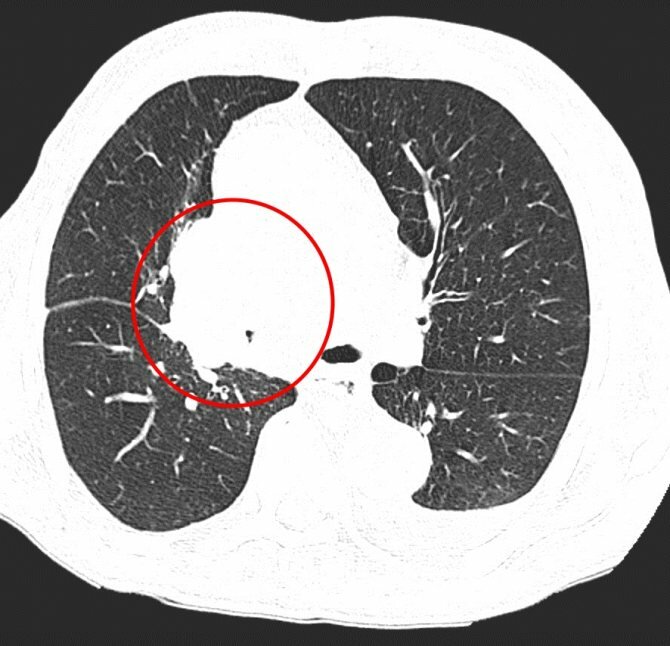
Центральный рак легкого на КТ. Обратите внимание на различия в ширине просвета центральных бронхов справа и слева. Просвет правого верхнедолевого бронха не виден. Виден ателектаз верхней доли. В круге – непосредственно само опухолевое образование, ставшее причиной ателектаза.
Периферический рак легких на КТ выглядит как очаг либо узел, расположенный на периферии органа вдалеке от корня. Обычно он имеет однородную структуру, в некоторых случаях с участками некроза, обызвествлениями и кровоизлияниями в паренхиму. Края типичной раковой опухоли неровные, с множественными «спикулами» за счет лимфангиита. При расположении вблизи плевры образование деформирует ее и подтягивает к себе. Размеры его различны – от очага (3-10 мм) до узла (10-50 мм и больше).
Типичный периферический рак легкого (аденокарцинома) на МСКТ. Справа в 6 сегменте легкого выявлен плотный мягкотканный узел со спикулами, деформирующий и подтягивающий к себе междолевую плевру.
Гораздо реже встречается первично множественный рак, который необходимо дифференцировать с метастазами и другими диффузными и диссеминированными очагами, в том числе туберкулезом. Существуют и диффузные формы опухолей – бронхиоло-альвеолярный рак (БАР), проявляющиеся на КТ в виде тотального либо субтотального снижения пневматизации по типу «матового стекла» – их нужно дифференцировать с пневмонией, отеком легких.
СТАДИИ РАКА ЛЕГВОГО ПО TNM И MOUNTAIN
Стадирование рака легкого необходимо для определения возможности удаления опухоли.
На стадиях T1 и T2 по Mountain операция возможна. T3a стадия означает, что опухоль, возможно, доступна резекции (чаще всего необходима пульмонэктомия), T3b и T4 стадии означают невозможность ее оперативного удаления.
При отсутствии метастазов в регионарные лимфоузлы или при наличии измененных лимфоузлов только на пораженной стороне (соответственно N0 и N1 по TNM) хирургическое лечение возможно и прогноз, скорее всего, благоприятен. На стадии N2 хирургическое лечение возможно после лучевой и (или) химиотерапии, прогноз сомнителен. При N3 хирургическое лечение не показано. Выявление метастазов в отдаленные органы также значительно ухудшает прогноз.
В таблице представлена классификация рака легкого по шкале TNM (UICC, 1999 г).
| Стадия (TNM) | Критерии |
| T1 | Опухолевый узел в паренхиме легкого до 3 см наибольшим размером без признаков прорастания в стенку центральных бронхов. |
| T2 | Внутрилегочная опухоль больше 3 см либо опухоль, инфильтрирующая стенку главного бронха как минимум на 2 см ниже зоны бифуркации либо опухоль, прорастающая висцеральную плевру. Ателектаз доли либо сегмента, но не тотальный. |
| T3 | Опухоль любого размера, инфильтрирующая главный или промежуточный бронх в менее чем 2 см от бифуркации или ограниченно прорастающая в средостенную плевру, средостение, грудную стенку. Может быть выявлен тотальный ателектаз либо пневмония обструкционного характера. |
| T4 | Опухоль любого размера с прорастанием в средостение, перикард, аорту, верхнюю полую вену, брахиоцефальную вену, в кости, грудную стенку. Выпот в грудную полость. Сателлитные очаги (внутрилегочные метстазы). |
| N0 | Нет поражения регионарных лимоузлов. |
| N1 | Поражение лимфоузлов корня, бронхопульмональных лимфоузлов на стороне опухоли. |
| N2 | Поражение бифуркационных, паратрахеальных, параэзофагеальных, парааортальных лимфатических узлов средостения на стороне опухоли. |
| N3 | Поражение лимфоузлов корня, средостения на противоположной опухоли стороне; поражение подмышечных, под- и надключичных, лестничных лимфоузлов. |
| M0 | Нет отдаленных метастазов. |
| M1 | Выявлены отдаленные метастазы (в т. ч. внутрилегочные очаги). |
Пример рака легких 4 стадии. Не показано оперативное лечение, только химиотерапия. Имеет место прорастание в ребра и позвоночник, а также в мягкие ткани грудной стенки. В строме опухоли видны множественные гиподенсные (темные) участки, содержащие газ – зоны распада.
ИЗЛЕЧИМ ЛИ РАК ЛЕГКИХ?
Излечим ли рак легких? Да, но только при своевременном выявлении на стадии T1 и T2. К сожалению, чем дальше от крупных бронхов располагается опухоль, тем более длительное время она может оставаться незамеченной, особенно если пациент «забывает» про своевременные флюорографические обследования.
КТ ПРИ РАКЕ ЛЕГКОГО И ВТОРОЕ МНЕНИЕ
Важный этап диагностики легочных онкологических заболеваний — анализ результатов КТ с точным выявлением всех признаков, влияющих на стадирование опухоли и выбор хирургической тактики. Учитывая высокую цену ошибки, такой анализ должен проводиться профессиональным специалистом-рентгенологом, который специализируется на диагностике легочных заболеваний. К сожалению, иногда расшифровка результатов КТ остается не на должном уровне. В таком случае результаты КТ, записанные на CD диск, можно отправить на пересмотр к более опытному специалисту и получить Второе мнение. В нашей стране любой пациент, столкнувшийся с необходимостью пересмотра результатов компьютерной томографии, может обратиться в сервисы Второго мнения, например в Национальную телерадиологическую сеть.
Василий Вишняков, врач-радиолог
Читать подробнее о Втором мнении
Читать подробнее о телемедицине
Павел Попов
Кандидат медицинских наук, член Европейского общества радиологов
Хондрома, липома, фиброма легких: лечение
Все доброкачественные опухоли подлежат хирургическому лечению, поскольку увеличение их размера может привести к тяжелым осложнениям (легочное кровотечение, пневмофиброз, абсцедирующая пневмония, ателектаз, бронхоэктазы). Хирургическое удаление доброкачественной опухоли обычно выполняется методом торакоскопии или эндоскопическим путем.
Операция выполняется торакальными хирургами. Объем хирургического вмешательства будет зависеть от размеров опухоли и масштабов пораженной ткани. Чем раньше было выявлено новообразование, тем меньше тканей будет удалено в ходе операции и более благоприятен прогноз.
Введение
Среди органов наиболее часто поражаемых метастазами, легкое занимает одно из ведущих мест. Известно, что изолированное метастазирование в легкие опухолей различной локализации варьирует от 6,5 до 50 и более процентов случаев, в зависимости от локализации первичного очага. По мнению ряда, при некоторых первичных локализациях (саркомы, хорионэпителиома, герминогенные опухоли яичка) в 60 – 80% случаев легкие в течение длительного времени являются единственным органом реализации метастазов. При поражении легких нередко в процесс вовлекаются листки плевры; их изолированное поражение встречается в полутора процентах случаев от числа патологии в легких и в 30% при вторичных поражениях.
Традиционные методы диагностики, такие как РТ, РКТ, МРТ и ПЭТ дают только предположительные данные о наличии очагового образования, а для решения проблемы морфологической верификации необходимы инвазивные методы исследования, но они имеют свои четкие показания и ограничения. Так не все объемные образования доступны для трансторакальной пункционной биопсии, а бронхоскопия позволяет получить материал только при интрабронхиальном расположении очага и находящегося в центральных отделах легких. Исходя из вышесказанного, проблема морфологической верификации и идентификации объемных образований легких и плевры весьма актуальна.
Торакоскопия или, если быть более точными, видео торакальная хирургия, позволяет снизить травматичность операции и во многом облегчает хирургическую диагностику перед консервативным лечением, позволяет оценить эффективность ранее проведенного консервативного лечения, помогает решить задачи дифференциальной диагностики и ведет к сокращению сроков пребывания больных в стационаре и соответственно снижению издержек системы здравоохранения. Эти преимущества делают видеоторакоскопию идеальным методом диагностики и лечения больных пожилого возраста и пациентов, которым недавно проводилось химиотерапия и/или лучевая терапия.
Задачи исследования
- Определить показания и противопоказания к видеоторакоскопии у больных с объемными образованиями легких и плевры.
- Оценить эффективность диагностической торакоскопии.
- Разработать методику и определить показания для предоперационной маркировки интрапаренхиматозно расположенных опухолевых очагов.
Материалы и методы
Настоящая работа основана на анализе результатов диагностики и лечения 115 больных перенесших торакоскопическое вмешательство на легких и плевре в ГУ РОНЦ им. Н.Н.Блохина РАМН. Средний возраст пациентов составил 43,2 и варьировал от 5 до 78 лет. Из них мужчин было 52, женщин – 63.
Что касается анамнеза и клинической картины метастатического процесса, необходимо отметить, что у 72 (62%) человек случаев процесс в легких протекал бессимптомно. Выраженность субъективной симптоматики нарастала по мере прогрессирования метастатического процесса в легком. К примеру, такие жалобы как боли в грудной клетке, одышка, похудание, слабость и кашель по отдельности выявлялись в 58% случаев. Кровохарканье отмечено у 2 (1,7%) больных. Общие симптомы, такие, как недомогание, слабость, субфебрилитет являлись спутниками процесса у 39% больных.
Из 71 пациента, которым проводилось противоопухолевое лечение до видеоторакоскопического вмешательства, лучевая терапия была только как компонент комплексного или комбинированного лечения, полихимиотерапия использовалась в 12 случаях, операция выполнена 21 пациенту. У 5 человек лечение было комплексное, а 33 пациента получили комбинированное лечение, в 90% из которых операция сочеталась с полихимиотерапией.
Всем больным перед оперативным вмешательством выполняли комплексное обследование, которое включало в себя анализы крови (общий анализ, биохимический анализ, коагулограмма), общий анализ мочи, функциональное обследование (спирометрия, ЭКГ, по показаниям – ЭхоКГ), ультразвуковое исследование (брюшной полости, малого таза, периферических лимфоузлов, забрюшинного пространства), РКТ органов грудной клетки. Сканирование костей скелета и компьютерная томография органов брюшной полости, определение уровня концентрации опухолевых маркеров в сыворотке крови выполняли по показаниям.
Из 115 оперированных больных в возрасте старше 50 лет было 48 человек, из них сопутствующую патологию имели 15 пациентов. Среди 67 больных в возрасте до 50 лет сопутствующая патология была выявлена у 11 человек. Общее число больных с отягощенным анамнезом составляет 26 человек (таблица 1).
Таблица 1.
Больные, перенесшие торакоскопическую операцию с сопутствующей патологией (n=59)
| Сопутствующая патология | Количество человек | Возраст min-max (средний) | ||
| Всего | Мужчины | Женщины | ||
| Сердечно-сосудистая патология | 8 | 2 | 6 | 46-78 (60) |
| Язвенная болезнь | 6 | 4 | 2 | 48-66(58,3) |
| Хроническая почечная недостаточность | 5 | 2 | 3 | 35-42(38) |
| Гепатит | 4 | 3 | 1 | 25-52(35,3) |
| Варикозная болезнь | 1 | 1 | — | 65 |
| Глаукома | 1 | — | 1 | 63 |
| Цирроз печени | 1 | — | 1 | 42 |
Наиболее подходящими для торакоскопической клиновидной резекции легкого с помощью сшивающего степлера являются субплевральные узлы и узлы, расположенные около латеральных краев легочных щелей и долей. В этих местах технически просто захватить паренхиму легкого, наложить аппарат и иссечь клиновидный участок ткани без большой деформации легочной ткани. Пальпация является наиболее важным первым шагом в определении границ узла, который может быть невидимым на поверхности легкого, или который может не вызывать явной деформации легочной ткани.
Патологический очаг, расположенный субплеврально, больших трудностей не вызывает, однако при интрапаренхиматозном расположении опухоли могут возникать определенные затруднения, которые решаются при выполнении предоперационной маркировки.
Прототипом разметки якорной иглой очага в легком послужила применяемая в клинической практике разметка небольших образований в молочной железе. Так в 21 случае из 115 визуализация объемных образований без предварительной разметки была невозможна. У этих пациентов с целью максимального сокращения времени, затраченного на поиск объемного образования во время операции, непосредственно перед операцией была выполнена предоперационная разметка с использованием якорной иглы под контролем РКТ. Методика заключалась в следующем: выполнялось стандартное компьютерное исследование на аппарате «CT-SOMATOM AR.STAR» производства фирмы Siemens, слой составлял 5мм, шаг 7мм, реконструкция по 3,5мм, исследование проводилось без задержки дыхания, после обнаружения искомого объемного образования при помощи меток отмечалась его проекция на коже. Затем, используя 20 мл шприц и стандартную внутримышечную иглу вводился местный анестетик, во всех случаях это был 0,5% раствор анекаина. После этого под контролем компьютерной томографии вводилась игла с мандреном в виде якоря. Применялась якорная игла длиной 12.0см. Мандрен (якорь) представляет собой загнутый, как «рыболовный крючок» металлический проводник. Затем, придерживая мандрен правой рукой, левой игла извлекается, при этом якорь остается в легком. После этого выполняется контрольное компьютерное исследование, чтобы убедиться, что маркер остался в легочной паренхиме. Во время операции в плевральной полости отчетливо визуализируется якорная игла, выполняется инструментальная пальпация (в 11 случаях очаг не пальпировался). После этого на расстоянии от 2 до 5 см от места входа проводника в легочную ткань (в зависимости от размеров очага и глубины его расположения) выполнялась резекция легкого аппаратом ENDO GIA — 30. В 7 случаях не было необходимости устанавливать дополнительный порт для манипулятора, так как якорь выполнял функцию атравматического зажима – вмешательство выполнено с использованием двух торакопортов (для торакоскопа и аппарата ENDO-GIA-30).
Результаты исследований.
Результаты морфологического исследования удаленного препарата у оперированных больных.
У 15 больных основной целью торакоскопического вмешательства было определение степени распространенности и морфологическая верификация опухолевого поражения плевры. В 7 случаях был обнаружен гидроторакс, но основным показанием для операции служили множественные очаги на висцеральной или париетальной плевре. В двух случаях плевральная жидкость носил геморрагический характер, в 5 был соломенно-желтого цвета. В 4 случаях когда количество жидкости не превышало 500 мл – дренаж удалялся на 1 или 2 сутки, а в 3 случаях когда в плевральной полости было обнаружено от 700мл до 2000мл – дренаж находился в плевральной полости от 3 до 6 дней.
У ряда больных при рентгенологическом исследовании органов грудной клетки, было обнаружено объемное образование в легочной ткани, в связи с чем возникала необходимость получения материала для морфологического исследования, с это целью выполнено 98 торакоскопических вмешательств, 93 из которых – резекции легкого и 5 – биопсия узлов расположенных на поверхности легкого. Опухолевое поражение париетальной и висцеральной плевры – в 15 (13%), в 2 (1,7%) случаях патологического очага не выявлено (таблица 2).
Таблица 2.
Распределение больных по характеру объемного образования в легком (n=115).
| Характер | Число больных |
| Метастазы солидной опухоли | 73 (63,5%) |
| Неопухолевые заболевания | 23 (20%) |
| Доброкачественные опухоли | 9 (7,8%) |
| Лимфопролиферативные заболевания | 8 (7%) |
| Патологический очаг не обнаружен | 2 (1,7%) |
Поражение верхней доли правого легкого имело место в 18 (15,7%) случаях, средней – в 8 (7%), нижней – в 31 (27%); верхней доли левого легкого – в 23 (20%), нижней доли – в 23 (20%). Причем в 5 случаях выполнялась билобарная резекция, а 2 раза торакоскопия выполнялась без воздействия на легочную ткань и плевру.
При анализе больных с метастатическим поражением легких опухолями солидного строения основную часть материала составили пациенты с остегенной саркомой, раком легкого, герминогенной опухолью, саркомой мягких тканей, раком почки (таблица 3). Таблица 3.
Локализация первичного очага у онкологических больных с солидными опухолями.
| Локализация первичного очага | Пол | Число больных | |
| Мужчины | Женщины | ||
| Остеогенная саркома | 8(10,9%) | 11(15,1%) | 19(26%) |
| Рак легкого | 6(8,2%) | 3(4,1%) | 9(12,3%) |
| Герминогенная опухоль | 9(12,3%) | — | 9(12,3%) |
| Саркома мягких тканей | 5(6,8%) | 2(2,7%) | 7(9,5%) |
| Рак почки | 4(5,5%) | 2(2,7%) | 6(8,2%) |
| Рак молочнщй железы | — | 4(5,5%) | 4(5,5%) |
| Злокачественная гистиоцитома | — | 4(5,5%) | 4(5,5%) |
| Рак ободочной кишки | 3(4,1%) | 1(1,4%) | 4(5,5%) |
| Мезотелиома плевры | 1(1,4%) | 2(2,7%) | 3(4,1%) |
| Трофобластическая болезнь | — | 3(4,1%) | 3(4,1%) |
| Рак прямой кишки | 1(1,4%) | — | 1(1,4%) |
| Рак кожи | — | 1(1,4%) | 1(1,4%) |
| Рак желудка | — | 1(1,4%) | 1(1,4%) |
| Карциноид легкого | 1(1,4%) | — | 1(1,4%) |
| Злокачественная шваннома | — | 1(1,4%) | 1(1,4%) |
| Итого | 38(52%) | 35(48%) | 73(100%) |
* – проценты вычислялись относительно числа больных с солидными опухолями.
В 23 случаях патологический очаг в легком был неопухолевой природы (таблица 4).
Таблица 4.
Структура неопухолевой патологии.
| Структура | Число больных |
| Туберкулез | 10(43,5%) |
| Фиброз легкого и плевры | 6(26,1%) |
| Абсцедирующая пневмония | 4(17,5%) |
| Альвеолярный протеиноз | 1(4,3%) |
| Грибковая пневмония | 1(4,3%) |
| Саркоидоз | 1(4,3%) |
| Итого | 23(100%) |
В связи с появлением широкого спектра эффективных противоопухолевых препаратов зачастую возникала необходимость оценить степень лечебного патоморфоза в патологическом очаге для выработки дальнейшей тактики ведения больного. С этой целью было выполнено 24 эндоскопических резекции легкого (таблица 5).
Таблица 5.
Распределение больных по степени лечебного патоморфоза.
| Патоморфологическое заключение | Всего | Степень патоморфоза | ||||
| 0 | I | II | III | IV | ||
| Саркома | 10 | 5 | 3 | 1 | 1 | 0 |
| Герминогенная опухоль | 8 | 0 | 0 | 2 | 1 | 5 |
| Злокачественная гистиоцитома | 2 | 1 | 0 | 0 | 1 | 0 |
| Рак молочной железы | 1 | 0 | 0 | 0 | 1 | 0 |
| Рак почки | 1 | 0 | 1 | 0 | 0 | 0 |
| Злокачественная шваннома | 1 | 1 | 0 | 0 | 0 | 0 |
| Нефробластома | 1 | 0 | 0 | 0 | 1 | 0 |
| Всего | 24 | 7 | 4 | 3 | 5 | 5 |
Сравнительный анализ различных методов маркировки патологического очага в легком.
Основная цель выполнения диагностической торакоскопии – получение материала для морфологической верификации диагноза. Эта задача решается без больших трудностей, когда объемное образование расположено субплеврально, но если оно находится в легочной паренхиме и не имеет никаких проявлений на плевре, появляется необходимость предоперационной разметки очага.
Во время торакоскопических операций в 5 случаях использовали УЗИ для определения места расположения патологического очага в легочной паренхиме, в одном – для определения возможности выполнить биопсию опухоли средостения. Лишь в 2 случаях удалось обнаружить очаг, хотя для этого потребовалось полное коллабирование легкого, вследствие чего увеличивалось время операции, оно составило от 40 до 60 минут. В 3 случаях очаг обнаружить не удалось. Метод не является ивазивным и, следовательно, не несет опасности для пациента, однако диагностическая ценность не высока, к тому же стоимость эндоскопического УЗ датчика, и УЗ аппарата, в значительной степени увеличивает стоимость оборудования.
Предоперационная разметка интрапаренхиматозных очагов в легких якорной иглой под контролем РКТ выполнялась в 21 случае. Возможные осложнения, как при любой трансторакальной пункции, заключались в возможном пневматораксе и развитии кровотечения, но поскольку сразу после разметки пациент поступал в операционную, эти осложнения можно было сразу устранить. Кровотечений отмечено не было в 3 случаях определялось незначительное количество воздуха в плевральной полости.
Показания и противопоказания для выполнения предоперационной разметки якорной иглой интрапаренхиматозных очагов в легких под контролем РКТ для последующей их торакоскопической резекции.
Показанием для выполнения предоперационной разметки очагов, расположенных в паренхиме легкого, являлись: расположение объекта на глубине от 0,5 от висцеральной плевры (по данным РКТ). Оптимальным условием, позволяющим выполнять маркировку очага, является доказанное расположение объемного образования на глубине не более 40мм, иначе при выполнении данной манипуляции повышается риск повредить иглой крупный сосуд или бронх. Размеры очага, требующие выполнения разметки не более 30мм; при большем размере объемного образования повышается эффективность его визуализации при инструментальной пальпации. Относительным противопоказанием могло являться расположение очага в проекции лопатки либо в непосредственной близости от позвоночника, поскольку приходится устанавливать якорь под большим углом по отношению к коже, а при коллабировании легкого увеличивается вероятность, что мандрен выйдет из паренхимы. Методика позволяет существенно упростить поиск патологического очага при выполнении торакоскопии и, тем самым, существенно сократить продолжительность операции.
Оценка эффективности диагностической торакоскопии.
Проводя сравнительную оценку предоперационного диагноза, который устанавливался по результатам РКТ и, в некоторых случаях, на основании трансторакальной пункционной биопсии легкого, с результатами диагностической торакоскопии разделили все 115 случаев на две основные группы (таблица 9 и 10):
Таблица 9.
Совпадение предоперационного диагноза и результатов торакоскопии (n = 74)
| Диагноз при поступлении | Совпадение диагноза при выписке (%) | |
| Метастаз рака в легкое | 29 | 23 (79%) |
| Метастаз саркомы в легкое | 25 | 22 (88%) |
| Метастазы без ВПО | 22 | 1 (5%) |
| Лимфопролиферативное заболевание | 13 | 8 (62%) |
| Метастаз герминогенной опухоли в легкое | 9 | 9 (100%) |
| Трофобластическая болезнь, метастаз в легкое | 4 | 3 (75%) |
| Метастаз злокачественной гистиоцитомы в легкое | 4 | 4 (100%) |
| Мезотелиома плевры | 5 | 3 (60%) |
| Метастаз злокачественной шванномы в легкое | 1 | 1 (100%) |
Анализируя данные этих таблиц, в первую группу вошли 74 (64,3%) больных с опухолевым поражением легких и плевры; предварительный диагноз был подтвержден и уточнен морфологически. Во вторую группу вошел 41 (35,7%) больной. У 8 (7%) – диагноз был уточнен, что привело к изменению тактики дальнейшего лечения. В 10 (8,7%) случаях опухолевое поражение было признано доброкачественным. Особо следует отметить, что в 23 случаях (20%) – обнаружены неопухолевые изменения, хотя предварительный диагноз злокачественного поражения был поставлен на основании данных рентгенологических методов исследования.
Таблица 10.
Расхождение предоперационного диагноза и результатов торакоскопии (n = 41)
| Диагноз при поступлении | Несовпадение диагноза при выписке (%) | |
| Метастаз рака в легкое | 26 | 8 (31%) |
| Метастаз саркомы в легкое | 24 | 3 (13%) |
| Метастазы без ВПО | 22 | 21 (95%) |
| Лимфопролиферативное заболевание | 13 | 5 (38%) |
| Трофобластическая болезнь, метастаз в легкое | 4 | 1 (25%) |
| Мезотелиома плевры | 4 | 2 (50%) |
| Опухоль переднего средостения | 1 | 1 (100%) |
Из всех оперативных вмешательств в 6 случаях торакоскопия дополнялась миниторакотомией и дважды – полноценной торакотомией. 5 торакотомий было выполнено до того, как в клинике был внеден метод предоперационной разметки интрапаранхиметозных очагов в легких под контролем КТ. Из этих случаев трижды торакотомия выполнялась из-за расположения очагов в паренхиме легкого и, соответственно, при торакоскопии обнаружить очаги не удавалось, один раз – из-за облитерации плевральной полости и один раз – в связи с выявлением абсцесса легкого, при этом была выполнена лобэктомия.
Выводы.
- Показаниями к диагностической торакоскопии у больных с объемными образованиями легких и плевры являются: а) оценка распространенности опухолевого процесса; б) утолщение или инфильтративные образования плевры; в) объемные образования легочной ткани; г) потребность дифференциальной диагностики различных опухолевых поражений; д) оценка выраженности лечебного патоморфоза после специального лечения.
- Абсолютным противопоказанием к диагностической торакоскопии являются грубые нарушения гомеостаза, не позволяющие провести общее обезболивание; относительное противопоказание – сочетание высшого риска такого вмешательства с относительной его диагностической ценностью.
- Диагностическая торакоскопия – высокоэффективный метод морфологической идентификации и верификации поражения легких и плевры (точность достигает 100%).
- Разработанная методика предоперационной маркировки интрапаренхиматозных очагов в легких якорной иглой под контролем РКТ позволяет ощутимо сократить длительность предстоящей операции устранением необходимости поиска патологического очага в ее ходе и предотвращает необходимость выполнения «открытой» операции.
- Показанием для выполнения предоперационной разметки очагов, расположенных в паренхиме легкого, является: доказанное расположение объекта на глубине не превышающей 40мм под висцеральной плеврой, его размеры не превышают 30мм. Относительным противопоказанием является расположение очага в проекции лопатки, либо в непосредственной близости от позвоночника.