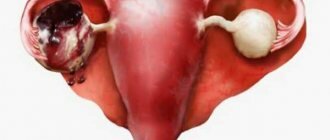
Зачастую восстановительный период после лапароскопии кисты яичника проходит для женщин быстро и безболезненно. Уже со второй недели женщина чувствует возобновление сил, возможность быть физически активной и трудоспособной. После лапароскопии кисты возможны и неожиданные последствия. Они могут быть вызваны индивидуальной непереносимостью на используемые для анестезии препараты, и быть совершенно непредсказуемыми.
Кроме этого, удаление кисты с помощью лапароскопии может вызвать спаечные процессы, лечение которых нельзя откладывать, чтобы не нарушить репродуктивную функцию женского организма. Также довольно часто развиваются и другие гинекологические заболевания после лапароскопического вмешательства. Более того, спайки являются довольно широкой проблемой при удалении кисты яичника после лапароскопии.
Если не соблюдать все рекомендации и предписания врача, послеоперационный режим, то развиваются серьезные инфекционные процессы в организме женщины. Среди специалистов лапароскопическое удаление кисты яичника считается несложным вмешательством. Но, несмотря на это, любая операционная манипуляция может нанести ущерб вашему организму, в том числе и повреждение яичника после лапароскопии. Чтобы избежать возможных неприятных последствий или свести их к возможному минимуму, после лапароскопии кисты яичника необходимо в течение года наблюдаться у врача и выполнять все его назначения. В период после операции рекомендуется и курс специальной консервативной терапии для восстановления организма.
Возможные осложнения после лапароскопии кисты яичника
Удаление кисты после лапароскопии только в двух случаях из ста не вызывает никаких последствий. Наиболее часто такие осложнения проявляются тошнотой, рвотой, быстрым, но незначительным повышением температуры до субфебрильных значений, которое может свидетельствовать об инфицировании кисты после лапароскопии. Почти сразу же к этим симптомам прибавляется озноб, а через некоторое время и лихорадка. Часто происходит и кровотечение из мест проколов троакарами.
Происходят случаи и серьезных послеоперационных осложнений, частота которых хоть и редкая, но не может не насторожить. В основном развитие осложнений со стороны яичников и других органов после лапароскопии зависит и от квалификации хирурга, который выполняет оперативное вмешательство. Осложнения в процессе лапароскопии часто связаны с повреждением сосудистых образований, соседних органов, а также нервных сплетений тазовой области.
Острый холецистит
Сейчас хирург зачастую выполняет «трудную» лапароскопическую холецистэктомию (ЛХЭ) у больных с запущенным острым холециститом. Препаровка не легка, время значительно, истечение из печени вызывает возмущение. Для окончания процедуры возможен переход к лапаротомии. Остаётся вопрос: резонно ли оставить дренаж в области ложа жёлчного пузыря или под печенью? Треть респондентов ответят «ДА» (табл.4). Обратите внимание, что акцент в вопросе был сделан на выражении «рутинный дренаж». Многие респонденты оставляют его селективно, при неблагоприятном закрытии пузырной культи или при ожидании активной экссудации.
Табл. 4. Вы ставите дренаж после открытой холецистэктомии (ОХЭ) или ЛХЭ по поводу тяжёлого острого холецистита?
| Количество | Нет | Да | |
| Северная Америка | 18 | 12 | 6 |
| Западная Европа | 10 | 8 | 2 |
| Восточная Европа | 7 | 1 | 6 |
| Латинская Америка | 15 | 14 | 1 |
| Азия | 15 | 7 | 8 |
| Австралия | 3 | 2 | 1 |
| Южная Африка | 3 | 3 | |
| Всего | 71 | 47 (66%) | 24 |
Послеоперационный период
Иногда после лапароскопии в местах проколов женщина чувствует незначительную боль, что считается вполне нормальным проявлением, так как это реакция организма на повреждение мягких тканей и хирургическое вмешательство. Такое явление никак не отразится на процессе выздоровления. Если же боль невыносима, то незамедлительно нужно обратиться за консультацией к специалисту для оценки состояния организма и раневой поверхности и назначения соответствующего лечения.
После лапароскопии яичников возникает сбой в менструальном цикле, а выделения из влагалища не опасны и считаются нормальным явлением. Они незначительны по объёму и слизистые по характеру, продолжительностью до нескольких недель. Тревожным симптомом может стать изменение цвета выделений на темно-зеленый или с коричневым оттенком, параллельно с признаками общей слабости, сонливости, повышенной температурой, сильной болью в пояснице. Эта ситуация говорит о присоединении патогенной микрофлоры и развитии инфекционного процесса.
Дренирование при разлитом перитоните
При разлитом перитоните только треть респондентов дренируют брюшную полость (табл.8).
Табл.8. Вы будете дренировать брюшную полость при разлитом перитоните?
| Количество | Нет | Да | |
| Северная Америка | 18 | 17 | 1 |
| Западная Европа | 10 | 8 | 2 |
| Восточная Европа | 7 | 2 | 5 |
| Латинская Америка | 15 | 12 | 3 |
| Aзия | 15 | 5 | 10 |
| Австралия | 3 | 2 | 1 (только таз) |
| Южная Африка | 3 | 1 | 2 |
| Всего | 71 | 47 (66%) | 24 |
Распределение ответов здесь идентично вопросам 3, 5, 6, 7. Азия и Восточная Европа верят в ценность дренажа при местной и диффузной внутрибрюшной инфекции. Нет сравнительных исследований дренирований и не дренирований при диффузном перитоните, так как тщетность дренирования в этой ситуации установлена много лет тому назад знатоками хирургической инфекции. Современный взгляд, представленный Обществом Хирургической Инфекции, сформулирован Rotstein and Meakins []: «Невозможно дренировать брюшную полость при разлитом перитоните. Поэтому использование дренажа у этих больных не показано, кроме случаев, когда (1) дренаж используют для послеоперационного промывания; (2) дренаж располагают в полости хорошо ограниченного абсцесса; (3) дренаж используют для формирования управляемого свища».
Я вспоминаю, когда я был младшим резидентом, у послеоперационных больных каучуковые дренажи торчали из всех квадрантов их вздутого живота. Эти трубки продуцировали некоторое количество старой крови, или, возможно, немного гноя или плохо пахнущей жидкости. Когда такой пациент умирал, причиной часто называли пневмонию. Насколько глупы мы были! Верили, что эти дренажи могут быть полезны! Постепенно мы пришли к пониманию, что они ничего не стоят: все внутрибрюшные дренажи забиваются окружающими тканями втечении 24-48 часов.
Единственное показание к использованию дренажа при разлитом перитоните – контроль за неконтролируемым (неудалимым) источником инфекции, как несостоятельность дуоденальной культи или эзофагогастроанастомоза. Я скептически отношусь к термину «хорошо ограниченный абсцесс» или «сформированный абсцесс», как показание к установке перитонеального дренажа. Такие абсцессы накапливают гной и представляют из себя часть разлитого перитонита. После опорожнения их следует лечить, как часть инфицированной брюшной полости, в ряду других перитонеальных мероприятий и антибиотикотерапии. Безусловно, перитонеальный лаваж отошёл в прошлое.
В заключении, важно понимать, что дренаж при разлитом перитоните бессмысленен. Однако, рецидивирующая или персистирующая внутрибрюшная инфекция может развиться, что потребует чрезкожного дренирования или реоперации. Дренаж этого не заменит. И тот факт, что у вас нет под рукой КТ, не должен менять показаний к дренированию, как будет показано ниже.
Рекомендации в период после лапароскопии кисты яичника
Согласно правилам пребывания в больничном заведении, после лапароскопии необходимо несколько дней для оценки состояния пациентки и механизмов адаптации. Если нет противопоказаний к выписке и признаков острого осложнения, то больную выписывают из отделения и рекомендуют следующее:
- в течение месяца воздерживаться от половых актов, чтобы дополнительно не травмировать яичники после лапароскопии, не спровоцировать инфекционное воспаление и предотвратить несостоятельность швов;
- не заниматься усиленными физическими упражнениями и спортом, а также не носить тяжелых предметов (сумок, пакетов);
- придерживаться диетического питания, ограничивать употребление соленого, острого, спиртных напитков в течение месяца после операции;
- в течение двух недель следует использовать лишь душ, а после воздействия воды промывать рану и швы антисептиками;
- Одевать легкую и необтягивающую одежду из натуральных тканей, чтобы не давить на органы и раневую поверхность.
Профилактика и лечение инфекционных осложнений у дренированных пациентов
10.10.2019
13814
0
| Т.С. Перепанова Д.м.н., профессор, зав. отд. инфекционно-воспалительных заболеваний и клинической фармакологии НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал «НМИЦ радиологии» Минздрава России (г. Москва) |
Тамара Сергеевна Перепанова, д.м.н., профессор НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал НМИЦр МЗ РФ в ходе 5й урологической интернет-конференции «Дренирование мочевых путей» дала подробное интервью по теме мероприятия. В беседе с научным редактором UroWeb.ru Викторией Анатольевной Шадеркиной, профессор рассказала об основных принципах профилактики и лечения инфекционно-воспалительных процессов при уходе за дренированными больными и перспективах развития этой области.
Тамара Сергеевна, наличие у пациентов тех или иных дренажей рассматривается как осложняющий фактор заболевания. Есть ли различия в ведении пациентов с нефростомами, дренажами, стентами, уретральными катетерами?
Т.С. Перепанова: Вы затронули самую актуальную тему в урологии, потому что развитие так называемых катетер-ассоциированных инфекций мочевых путей — бич всех без исключения больниц, не только российских. Уретральный катетер, конечно, более опасен, чем нефростома или цистостома. Он является фактором риска номер один не только для развития внутрибольничных инфекций мочевых путей, но и для развития уросепсиса. Порядка 70% септических осложнений связаны с установкой уретральных катетеров, стентов, нефростом и цистостом. Скажем, и врачи, и пациенты порой забывают об установленных стентах, и на этом фоне развивается синдром системной воспалительной реакции. Такое состояние ошибочно диагностируется как атака пиелонефрита, пневмония или что-то еще. На самом же деле стент или уретральный катетер являются тем очагом инфекции, который необходимо удалить до начала антимикробного лечения. Как только очаг инфекции удален, в течение 2–4х дней все нормализуется: и температура, и уровень лейкоцитов, и все прочие признаки системной воспалительной реакции. Это абсолютно типичная ситуация, и к нам регулярно поступают пациенты, которых месяцами лечили антибиотиками на фоне стента, стоявшего в течение нескольких месяцев.
Если мы говорим об уретральных катетерах, нефростомах и цистостомах, то первые из них, подчеркну, наиболее опасны. У мужчин при их использовании могут развиваться эпидидимит, орхит, простатит и так далее. К сожалению, с первых часов установки любого дренажа, особенно уретрального катетера, начинается его контаминация госпитальными штаммами микроорганизмов. Катетер, находящийся в организме пациента более семи дней, на 100% будет инфицирован.
Как вести таких пациентов? Конечно, обязательны асептические условия, стерильные перчатки, использование антисептического геля при установке. Раньше практиковалась ежедневная обработка антисептиками, сегодня уже показано, что это никакого значения не имеет, важны только антисептические гели при установке уретрального катетера. Главное — не промывать катетеры и дренажи. При промывании все биопленки на поверхности катетера, все микроорганизмы «загоняются» внутрь больного. При таком массивном поступлении микроорганизмов выделяются эндотоксины и развивается системная воспалительная реакция. В таком случае также важно понимать, что это не атака пиелонефрита, например, а попадание токсина в кровь, и здесь возможен эндотоксический шок.
Мы общаемся с врачами и пациентами в регионах и, к сожалению, видим, что промывание эпицистостом — распространенная практика.
Т.С. Перепанова: Единственным показанием для промывания является гематурия, тампонада мочевого пузыря, но даже в этом случае рекомендуется сменить цитостомический дренаж на стерильный и промывать уже через него.
Какие возбудители сейчас чаще всего становятся причиной воспалительной реакции?
Т.С. Перепанова: На протяжении последних десятилетий основными возбудителями мочевой инфекции и катетер-ассоциированной инфекции являются энтеробактерии. Это уропатогенная кишечная палочка E. сoli, Klebsiella pneumoniae, которая сегодня обладает уже двумя-тремя факторами устойчивости, мультирезистентностью. Она может быть устойчива к карбопенемам. Затем протейные инфекции, синегнойная палочка, а при катетер-ассоциированной инфекции может обнаруживаться и Candida, поскольку грибы быстро растут на катетерах. Кандидозные инфекции мочевых путей встречаются достаточно редко, и, если грибы высеиваются при исследовании — скорее всего, это посев катетера.
Показано ли бактериальное исследование больным с уретральным катетером?
Т.С. Перепанова: Как рутина не рекомендуется. Если мы говорим о больных перед операциями — конечно, нужно удалить имеющийся катетер и поставить стерильный, если без него невозможно обойтись, или же поменять цистостомический дренаж, и только после этого взять посев мочи. Мы должны знать состав флоры, если возникнут какие-то осложнения после операции. Но рутинно это не требуется, потому что, по большому счету, не требуется никакого лечения: формируются биопленки, и сегодня не существует даже фиксированных периодов замены катетеров или дренажей.
В каких случаях показано назначение антибактериальных препаратов пациентам с дренажами?
Т.С. Перепанова: Если наблюдается лихорадка на фоне присутствия катетера или стента, если развился синдром системной воспалительной реакции, который может очень быстро перейти в острый пиелонефрит, сепсис и септический шок. Опять же, прежде чем начинать антибактериальную терапию, нужно убрать источник инфекции — катетер, при необходимости заменив его на стерильный. Стенты в большинстве случаев просто убирают безо всякой замены. Уже после этого начинается антибиотикотерапия. У пациентов с эпицистостомой — то же самое. Еще раз скажу, что промывать их нельзя.
Второе показание — у больных перед эндоскопическими вмешательствами, где предполагается инцизия слизистых. Опять повторю – после удаления инфицированного катетера или замены его на стерильный.
А показана ли антибактериальная терапия пациентам с нефростомами, или там все зависит от конкретной ситуации?
Т.С. Перепанова: Да, зависит, конечно, от клинической ситуации. Если, опять же, началась системная воспалительная реакция, поднялась температура, — меняем дренаж на стерильный и после этого начинаем антимикробное лечение в соответствии с посевом. Рутинно, для профилактики оно не назначается. Это, во-первых, бесполезно, во-вторых, вредно. Мы только селекционируем резистентные штаммы таким образом. Длительные антибактериальные курсы, особенно на фоне стентов, абсолютно не нужны.
Сегодня остается актуальной проблема биопленок. Появились ли какие-то препараты, которые воздействуют на них?
Т.С. Перепанова: Знание о биопленках мы получили относительно недавно, вместе с появлением электронных микроскопов. В мире, конечно, очень активно работают с биопленками, и мы тоже стараемся на них влиять. К сожалению, сама структура биопленок, в которую входят масса микроорганизмов и матрикс, препятствует этому. В биопленку могут проникать фторхинолоны и макролиды, но матрикс «выкидывает» антибиотики методом эффлюкса. Потом, все разрабатываемые антибиотики, рассчитанные на живые размножающиеся микроорганизмы, не действуют на микроорганизмы, находящиеся внутри биопленки, где они меняют свою форму, у них ослаблен метаболизм, поэтому на них существующие антибиотики и не влияют. Разрабатываются новые препараты неантимикробного действия, они проникают, например, в протеины. Мы, в свою очередь, начали работу с бактериофагами. Это российское достояние, Советский Союз и Россия были первыми на этом поле, и мы единственная страна, где налажен промышленный выпуск бактериофагов.
Недавно мы провели исследование: перед перкутанной нефролитотрипсией обрабатывали катетеры в течение получаса бактериофагом. Перед этим провели предварительную работу с Институтом микробиологии имени Н.Ф. Гамалеи, чтобы точно установить нужный отрезок времени. Было установлено, что бактериофаги действуют на раннюю сформировавшуюся биопленку — всего 6–8 часов. После 8–12 часов развивается зрелая биопленка, на которую не действуют уже и фаги. Интересно, что на катетерах, извлеченных через сутки, в 3х из 30-ти случаев в самой биопленке был обнаружен живой бактериофаг. Значит, он туда проник, и это уже обнадеживает. Мы пытаемся сейчас разработать, к примеру, гелевые формы бактериофагов, чтобы они лучше удерживалась на катетерах, но тут тоже не так все просто.
Какой механизм действия фагов?
Т.С. Перепанова: Бактериофаг запускает свою ДНК в бактерию. Дальше из составляющих бактерии — из митохондрий, из ядра — он начинает формировать свои вирионы, то есть развивается вирусная инфекция среди бактерий. Из содержимого клетки начинают формироваться «детеныши» фагов. В итоге клетка лизируется, из нее выходят новые вирионы и заражают соседние клетки. По большому счету, сам фаг внедряется и погибает, но из его ДНК развивается дальнейший процесс уничтожения бактерий.
Выглядит перспективно. Наверное, несправедливо, что в течение 10–20 лет фаги были забыты?
Т.С. Перепанова: Их открыли в 1918 году и в 30-е годы после всех экспериментальных исследований начали активно пробовать на людях. Но потом в 1938 году открыли пенициллин. Естественно, эффект был мощным. Думали, что им можно вылечить все, но, конечно, резистентность стала развиваться сразу же. Сегодня проблема антибиотикорезистентности в числе первых в мире. Даже новые дорогие антибиотики не успевают за ней. Поэтому фаги сейчас снова рассматриваются как перспективный метод.
Скажите, пожалуйста, Тамара Сергеевна, есть ли какие-то общие принципы ведения пациентов с урологическими дренажами?
Т.С. Перепанова: Главное — стараться дренажи/катетеры/стенты вообще не ставить, а при необходимости — как можно меньше держать. Понятно, что абсолютно обойтись без катетеров и дренажей в урологии мы не можем, но в части инфекционных осложнений у больных с нарушениями мочеиспускания более безопасна интермиттирующая катетеризация. У мужчин также возможно применение уропрезервативов. Затем, сама установка должна производиться в стерильных условиях и со стерильными перчатками. Общие принципы: не промывать, использовать антисептические гели только при установке, убирать при первой возможности, не кормить пациента антибиотиками и уросептиками без показаний.
В последнее время контроль над применением антибиотиков усилился, многие аптеки их уже не продают без рецепта. Что еще можно сделать в этом направлении?
Т.С. Перепанова: Хорошо, что Вы ведете свои интервью и программы на подобные темы. Мы тоже организовали школу по рациональной фармакотерапии в урологии. Уже было показано, что образовательные программы, особенно в том, что касается катетер-ассоциированных инфекций, имеют огромное значение. Уровень распространенности инфекций снижается на 70% после проведения образовательных программ среди медицинских работников, а также пациентов. Люди узнают о том, что не нужно промывать дренажи, о том, что их нужно убирать и менять на стерильные прежде, чем назначить антибиотик, и так далее.
Конечно, образовательный процесс должен быть беспрерывным. Постоянно появляются новые данные клинических исследований, нужно следить за ними.
Т.С. Перепанова: Совершенно верно. Сейчас мы обновляем федеральные клинические рекомендации 2021 года. Сделаем, наверное, отдельную вкладку по уходу за катетерами. Врачи не всегда могут уделить время чтению научных журналов, а так они увидят то, что нужно.
В целом какие перспективы Вы видите в ведении пациентов с дренажами?
Т.С. Перепанова: К сожалению, никакое покрытие, даже антимикробное, не дает страховки от инфекции. Катетеры с импрегнированным серебром чуть лучше себя показывают на сроках до семи дней, но после семи дней все едино, повышается риск развития инфекции. Со стороны катетеров нет защиты. Это не слизистая мочевых путей, в которой есть цитокины, антимикробные пептиды и так далее. У катетера нет иммунитета слизистых оболочек, поэтому начинается строительство биопленок. К тому же, большинство микроорганизмов вырабатывают уреазу — фермент, который разлагает мочевину мочи на аммиак и СО2. При этом рН меняется в щелочную сторону и начинают оседать кристаллы. Эти кристаллы выпадают на любое покрытие, и уже на них микробы начинают строить биопленку.
По большому счету и наши, и международные усилия сейчас привели к тому, что хотя бы после ТУР, после перкутанных вмешательств катетер на первые сутки удаляется. Это уже огромный прогресс, потому что раньше их держали до выписки.
Последний момент — мочеприемники. Катетер, собирательные трубки и мочеприемник — это единая система, которую нельзя нигде разъединять, особенно во время дежурства, грязными руками. Открывается только клапан мешка, чтобы слить мочу. Любое разъединение может привести к передаче инфекции. Если оно необходимо, нужно все делать в стерильных перчатках и потом мыть руки, прежде чем перейти к следующему больному, иначе переносятся госпитальные штаммы микроорганизмов. Самое главное — санитария и гигиена.
Спасибо за интервью!
Материал подготовила В.А. Шадеркина научный редактор UroWeb.ru
Полную видеоверсию мероприятия можно посмотреть на Uro.TV
Статья опубликована в журнале «Дайджест урологии» №4-2019
Тематики и теги
Инфекция в урологии
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться